题目内容
硫铁矿(FeS2)高温下煅烧,发生反应4FeS2+11O2→8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:(1)1.00mol FeS2完全氧化,需要空气的体积(标准状况)为______L.
(2)55L空气和足量FeS2完全反应后,气体体积(同温同压)变为______L.
(3)用空气氧化FeS2产生的气体混合物中,O2含量为0.0800,则SO2的含量为______.
【答案】分析:(1)根据方程式计算需要氧气的物质的量,再根据V=nVm氧气的体积,根据空气中氧气的体积分数计算需要空气的体积;
(2)计算空气中氧气的体积,利用差量法计算反应后气体体积变化,据此解答;
(3)令空气的物质的量为1mol,设参加反应的氧气物质的量为xmol,利用差量法计算反应后气体体积变化,进而计算反应后的总体积,根据氧气的体积分数列方程计算x的值,再根据体积分数定义计算.
解答:解:(1)根据方程式4FeS2+11O2=8SO2+2Fe2O3可知,1.00molFeS2完全氧化需要氧气物质的量=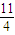 mol,
mol,
故需要空气的体积=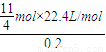 =308L,
=308L,
故答案为:308L;
(2)55L空气中氧气的体积=55L×0.2=11L,则:
4FeS2+11O2=8SO2+2Fe2O3 气体体积减少△V
11 11-8=3
11L 3L
故反应后气体的体积为55L-3L=52L,
故答案为:52L;
(3)令空气的物质的量为1mol,设参加反应的氧气物质的量为xmol,则:
4FeS2+11O2=8SO2+2Fe2O3 气体物质的量减少△n
11 11-8=3
xmol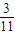 xmol
xmol
故反应后气体的物质的量=1mol-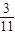 xmol
xmol
故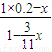 =0.08,解得x=0.197
=0.08,解得x=0.197
故生成二氧化硫为0.197mol×
故气体混合物中SO2的含量=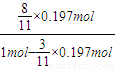 =0.15
=0.15
故答案为:0.15.
点评:本题考查根据方程式的计算,注意利用差量法计算的计算,难度不大.
(2)计算空气中氧气的体积,利用差量法计算反应后气体体积变化,据此解答;
(3)令空气的物质的量为1mol,设参加反应的氧气物质的量为xmol,利用差量法计算反应后气体体积变化,进而计算反应后的总体积,根据氧气的体积分数列方程计算x的值,再根据体积分数定义计算.
解答:解:(1)根据方程式4FeS2+11O2=8SO2+2Fe2O3可知,1.00molFeS2完全氧化需要氧气物质的量=
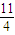 mol,
mol,故需要空气的体积=
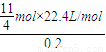 =308L,
=308L,故答案为:308L;
(2)55L空气中氧气的体积=55L×0.2=11L,则:
4FeS2+11O2=8SO2+2Fe2O3 气体体积减少△V
11 11-8=3
11L 3L
故反应后气体的体积为55L-3L=52L,
故答案为:52L;
(3)令空气的物质的量为1mol,设参加反应的氧气物质的量为xmol,则:
4FeS2+11O2=8SO2+2Fe2O3 气体物质的量减少△n
11 11-8=3
xmol
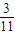 xmol
xmol故反应后气体的物质的量=1mol-
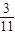 xmol
xmol故
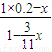 =0.08,解得x=0.197
=0.08,解得x=0.197故生成二氧化硫为0.197mol×

故气体混合物中SO2的含量=
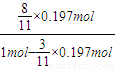 =0.15
=0.15故答案为:0.15.
点评:本题考查根据方程式的计算,注意利用差量法计算的计算,难度不大.

练习册系列答案
相关题目