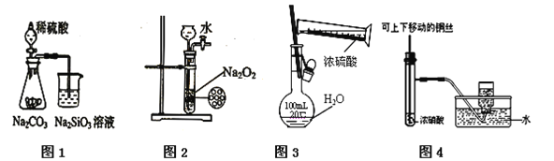
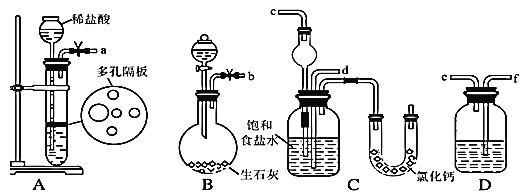
题目内容
【题目】(1) 与氢气反应的化学方程式是__________;
与氢气反应的化学方程式是__________;
(2)写出正戊烷CH3(CH2)3CH3的两种同分异构体的结构简式和名称(系统命名法):
①结构简式:_____________、名称:_____________
②结构简式:_____________、名称:_____________。
(3)某一氯代烷烃分子中有2个“-CH3”、2个“-CH2-”、1个“ ”和1个“-Cl”,符合上述条件的有机物共四种,写出它们的结构简式:
”和1个“-Cl”,符合上述条件的有机物共四种,写出它们的结构简式:![]() 、
、 、_________、_________。
、_________、_________。
【答案】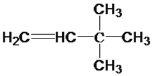 +H2
+H2![]() CH3CH2C(CH3)3 :CH3CH(CH3)CH2CH3 2-甲基丁烷 CH3C(CH3)3 2,2-二甲基丙烷 CH3CH2CHClCH2CH3 CH2ClCH(CH3)CH2CH3
CH3CH2C(CH3)3 :CH3CH(CH3)CH2CH3 2-甲基丁烷 CH3C(CH3)3 2,2-二甲基丙烷 CH3CH2CHClCH2CH3 CH2ClCH(CH3)CH2CH3
【解析】
(1)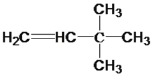 与氢气反应的化学方程式为:
与氢气反应的化学方程式为: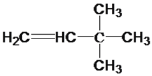 +H2
+H2![]() CH3CH2C(CH3)3。本小题答案为:
CH3CH2C(CH3)3。本小题答案为: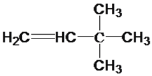 +H2
+H2![]() CH3CH2C(CH3)3。
CH3CH2C(CH3)3。
(2)戊烷有3种同分异构体,分别为CH3(CH2)3CH3、CH3CH(CH3)CH2CH3、CH3C(CH3)3。
①正戊烷的一种同分异构体为CH3CH(CH3)CH2CH3 ,名称为2-甲基丁烷。本小题答案为:CH3CH(CH3)CH2CH3 2-甲基丁烷。
②正戊烷的另外一种同分异构体为CH3C(CH3)3,名称为2,2-二甲基丙烷。本小题名称为:CH3C(CH3)3 2,2-二甲基丙烷。
(3)5个碳的烷烃碳骨架异构有①![]() ②
②![]() ③
③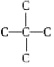 。①中的一氯代烃符合题意的有CH3CHClCH2CH2CH3、CH3CH2CHClCH2CH3两种;②中符合题意的有CH2ClCH(CH3)CH2CH3、(CH3)2CHCH2CH2Cl。③中没有符合题意的情况。本小题答案为: CH3CH2CHClCH2CH3 ;CH2ClCH(CH3)CH2CH3。
。①中的一氯代烃符合题意的有CH3CHClCH2CH2CH3、CH3CH2CHClCH2CH3两种;②中符合题意的有CH2ClCH(CH3)CH2CH3、(CH3)2CHCH2CH2Cl。③中没有符合题意的情况。本小题答案为: CH3CH2CHClCH2CH3 ;CH2ClCH(CH3)CH2CH3。

【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化变成绿色;见光分解变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl)生产CuCl的流程:
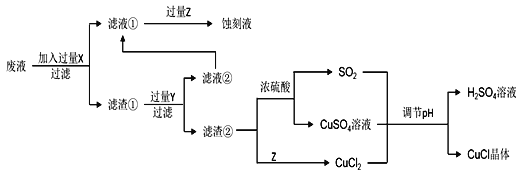
根据以上信息回答下列问题:
(1)生产过程中X的化学式为____。
(2)写出产生CuCl的离子方程式:____。
(3)实验探究pH对CuCl产率的影响如表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为____,当pH较大时CuCl产率变低原因是____。调节pH时,___(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是____。
(4)氯化亚铜的定量
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10mol·L1硫酸铈标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。三次平行实验结果如表(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_____。(结果保留三位有效数字)。
(5)由CuCl水解再热分解可得到纳米Cu2O。第一步CuCl水解的离子方程式为:CuCl(s)+H2O(l)![]() CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
CuOH(s)+Cl (aq)+H+(aq),第二步CuOH热分解的化学方程式为____。第一步CuCl水解反应的平衡常数K与此温度下KW、Ksp(CuOH)、Ksp(CuCl)的关系为K=____。
【题目】资源化利用CO具有重要意义。
(1)CO可设计成燃料电池,熔融Li2CO3和Na2CO3的混合物作为燃料电池的电解质,氧化剂是含CO2的O2,工作时正极反应为__________________,以该燃料电池为电源处理含氮氧化物废气,可回收硝酸,同时制得副产物氢气,装置如图所示(电极均为石墨电极)。该装置中应选用_______(填“阴”或“阳”)离子交换膜,写出电解时NO2发生反应的电极反应式:___________________。

(2)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
反应 | △H(kJ/mol) |
I. Fe2O3(s)+3C(s) | +489 |
II. Fe2O3(s)+3CO(g) | -27 |
III. C(s)+CO2(g) | X |
试计算,试计算,X=_________。
T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应I,反应达到平衡后,在t1时刻改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是_____________________。
a.保持温度、体积不变,使用催化剂 b.保持体积不变,升高温度
c.保持温度不变,压缩容器体积 d.保持温度、体积不变,充入CO

(3)在一定温度下,向某体积可变的恒压(P总)密闭容器中加入1mol CO2与足量的碳发生反应III,平衡时体系中气体体积分数与温度的关系如图所示。
①650℃时,反应达平衡后CO2的转化率为____________。
②T℃时,该反应达到平衡时下列说法不正确的是__________________。
a.气体密度保持不变
b.2v正(CO2)=v正(CO)
c.若保持其它条件不变再充入等体积的CO2和CO,平衡向逆反应方向移动
d.若保持其它条件不变再充入惰性气体,v正、v逆均减小,平衡不移动
e.若其它条件不变将容器体积压缩至一半并维持体积不变,再次达平衡时压强小于原平衡的2倍
③根据图中数据,计算反应III在T℃时用平衡分压代替平衡浓度表示的化学平衡常数KP=___________(设总压强为P总,用含P总的代数式表示)