题目内容
【题目】![]() 是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:
是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:
(1)已知:![]() ,
,![]() ,
,![]() 。设计最简单的方法鉴别
。设计最简单的方法鉴别![]() 和
和![]() 两种固体: __________________________________。
两种固体: __________________________________。
(2)利用下图装置(略去夹持仪器)制备

已知:![]() ;酸性条件下,
;酸性条件下,![]() 和
和![]() 均能与
均能与![]() 迅速反应生成
迅速反应生成![]() 和
和![]() 。
。
①装置A中发生反应的离子方程式为__________________________________;
这样安放铜丝比将铜片浸于液体中的优点是__________________________。
②装置B中反应的化学方程式为________________________________。
③干燥剂X的名称为__________,其作用是____________________。
④上图设计有缺陷,请在F方框内将装置补充完全,并填写相关试剂名称___________。
(3)测定产品的纯度。
取![]() 制取的样品溶于水配成
制取的样品溶于水配成![]() 溶液,取
溶液,取![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 酸性
酸性![]() 溶液进行滴定,实验所得数据如下表:
溶液进行滴定,实验所得数据如下表:
滴定次数 | 1 | 2 | 3 | 4 |
消耗 | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次滴定实验数据异常的原因可能是______(填字母序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.当观察到最后一滴溶液滴入待测液中红色慢慢褪去,定为滴定终点
D.滴定终点时俯视读数
②酸性![]() 溶液滴定
溶液滴定![]() 溶液的离子方程式为__________________。
溶液的离子方程式为__________________。
③该样品中![]() 的质量分数为__________。
的质量分数为__________。
【答案】分别取等量的两种固体样品少量于试管中加水至溶解,再分别滴加酚酞试液,变红的为NaNO2 Cu+4H++2NO3-= Cu2++2NO2↑+2H2O 可以控制反应的发生与停止 3NO2+H2O =2HNO3+NO 碱石灰 吸收B中挥发出的硝酸和水蒸气 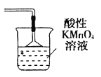 A 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O 69%(或
A 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O 69%(或![]() )
)
【解析】
(1) 根据NaCl、NaNO2盐的组成及溶液的酸碱性分析判断;
(2)装置A中是浓硝酸和铜加热发生的反应,反应生成二氧化氮和硝酸铜和水,NO2与装置B中的水反应产生HNO3和NO,通过装置C中的干燥剂吸收水蒸气,在装置D中与Na2O2发生反应,装置E中的干燥剂防止水蒸气进入,通过装置E中的过氧化钠与一氧化氮反应,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气。
(3)①第一次实验数据出现异常,消耗KMnO4溶液体积偏大,根据c(待测)=![]()
分析不当操作对V(标准)的影响,以此判断浓度的误差;
②在反应中NO2-被氧化为NO3-,MnO4-被还原为Mn2+;
③根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可求出亚硝酸钠的物质的量,然后求样品中亚硝酸钠的质量分数。
(1) NaCl是强酸强碱盐,不水解,溶液显中性;NaNO2是强碱弱酸盐,NO2-水解,消耗水电离产生的H+,最终达到平衡时溶液中c(OH-)>c(H+),溶液显碱性,所以可根据盐溶液的酸碱性的不同进行鉴别。分别取等量的两种固体样品少量于试管中加水至溶解,然后分别滴加酚酞试液,溶液变红的为NaNO2,不变色的为NaCl;
(2)①在装置A中Cu与浓硝酸发生反应,产生硝酸铜、二氧化氮和水,反应的离子方程式为:Cu+4H++2NO3-= Cu2++2NO2↑+2H2O;这样安放铜丝,可通过上下移动铜丝控制反应是否进行,所以使用铜丝的优点是可以控制反应的发生与停止;
②装置B中水与二氧化氮反应生成硝酸和一氧化氮,反应方程式为3NO2+H2O =2HNO3+NO;
③在干燥管中盛放的干燥剂X的名称为碱石灰,其作用是吸收B中挥发出的硝酸和水蒸气;
④NO及NO2都是大气污染物,随意排入大气会造成大气污染,故上图设计的缺陷是无尾气吸收装置。可根据NO、NO2都会被酸性KMnO4溶液吸收,产物都在溶液中,为防止倒吸现象的发生,在导气管末端安装一个倒扣的漏斗,装置为 ;
;
(3)①A.酸式滴定管用蒸馏水洗净后未用标准液润洗,标准液的浓度偏小,根据c(待测)=![]() 分析可知,造成V(标准)偏大,A可能;
分析可知,造成V(标准)偏大,A可能;
B.锥形瓶洗净后未干燥,待测液的物质的量不变,对V(标准)无影响,B不可能;
C.当观察到最后一滴溶液滴入待测液中红色慢慢褪去,就定为滴定终点,此时溶液中NO2-未反应完全,消耗标准溶液体积偏小,C不可能;
D.滴定终点时俯视读数,造成V(标准)偏小,D不可能;
故合理选项是A;
②在反应中NO2-被氧化为NO3-,MnO4-被还原为Mn2+,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
③消耗KMnO4溶液体积V=![]() =20.00mL,消耗高锰酸钾的物质的量是n(MnO4-)=0.1mol/L×0.02L=0.002mol,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量n(NaNO2)=0.002mol×
=20.00mL,消耗高锰酸钾的物质的量是n(MnO4-)=0.1mol/L×0.02L=0.002mol,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量n(NaNO2)=0.002mol×![]() =0.005mol,则原样品中亚硝酸钠的物质的量是n(NaNO2)总=0.005mol×
=0.005mol,则原样品中亚硝酸钠的物质的量是n(NaNO2)总=0.005mol×![]() =0.02mol,其质量m(NaNO2)=0.02mol×69g/mol=1.38g,则样品中亚硝酸钠的质量分数
=0.02mol,其质量m(NaNO2)=0.02mol×69g/mol=1.38g,则样品中亚硝酸钠的质量分数![]() ×100%=69.0%。
×100%=69.0%。

 天天向上口算本系列答案
天天向上口算本系列答案


