题目内容
反应CO(g)+NO2(g)  CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(NO2),平衡常数为K2,则
CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(NO2),平衡常数为K2,则
 CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(NO2),平衡常数为K2,则
CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(NO2),平衡常数为K2,则| A.若增大CO浓度,K2和K1都增大 | B.K2>K1 |
| C.c2(CO)=c2(NO2) | D.c1(CO)>c2(CO) |
C
试题分析:A.可逆反应的化学平衡常数K只与温度有关,而与物质的浓度的大小无关。因此若增大CO浓度,K2和K1都不变。错误。B.由于该反应的正反应为放热反应,所以升高温度,化学平衡向吸热反应方向即逆反应方向移动,这时化学平衡常数减小。故K1>K2。错误。C.由于在温度t1时达到平衡,c1(CO) =c1(NO2)。在反应方程式中二者的物质的量的比为1:1,所以改变条件时它们改变的物质的量的比也是1:1,因此达到新的平衡后二者的浓度仍然相等。所以c2(CO)=c2(NO2)。正确。 D.在温度t1时达到平衡,CO的浓度为c1(CO) ,升高温度,化学平衡向逆反应方向移动,所以当达到新的平衡后CO的浓度c2(CO) >c1(CO)。错误。

练习册系列答案
相关题目
 2HF
2HF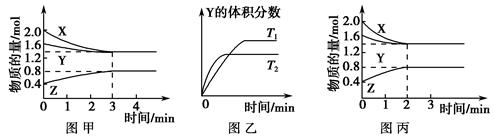
 2Z(g)
2Z(g)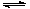 CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-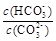 减小
减小 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是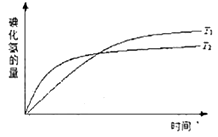
 CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
 CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动