题目内容
过碳酸钠(Na2CO4)和稀硫酸反应的化学方程式为2Na2CO4+2H2SO4请回答下面问题:
(1)甲同学想通过实验测得的数据是_________。他使用装置③_______(填“有”或“没有”)必要。
(2)乙同学想通过实验测得的数据是_________。按他测得的数据计算出的实验结果_________。(填“偏高”或“偏低”),理由是____________________________________________。
(3)为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序:___________________________。
(4)按你设计的实验装置进行实验,若测得实验前后装置②的质量分别是W1和W2,则样品中过碳酸钠的质量分数为_________。
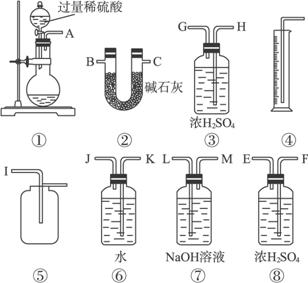
解析:(1)⑦中NaOH吸收了CO2,⑥④是测气体体积的装置,所以测量的是O2的体积,由于采用排水法测体积,所以干燥是没必要的。
(2)碱石灰吸取CO2,同时也吸水气,所以乙测的是CO2的质量(常温下水是液态),其结果偏高。
(3)在②前加干燥装置除去水气,在②后加干燥装置防止空气中水、CO2干扰。
(4)m(CO2)=W2-W1,n(Na2CO4)=n(CO2)=![]() (mol)
(mol)
m(Na2CO4)=122![]() (g)
(g)
ω=![]() ×100%=
×100%=![]()
答案:(1)氧气的体积 没有
(2)二氧化碳的质量 偏高 气体中的水蒸气被碱石灰吸收,同时空气中的二氧化碳和水蒸气也被碱石灰吸收
(3)AHGBCFE或AFEBCHG(B、C可交换)
(4)![]()

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目