题目内容
甲、乙两个研究小组,用以下两种方法由Cu粉制Cu(NO3)2溶液.
(1)甲组用a g Cu粉,在加热条件下,与空气充分反应,然后将生成的CuO全部溶于适量的稀HNO3溶液中,制得Cu(NO3)2溶液.则消耗的O2的物质的量是______,消耗的HNO3的物质的量是______
(2)乙组用a g Cu粉全部溶于一定量的浓HNO3中,测得生成的气体在标准状况下体积为b L (不考虑NO2转化成N2O4).则消耗的HNO3的物质的量是______mol.为消除污染,将生成的气体通入水中并同时通入O2,使生成的气体完全溶于水,则消耗O2的物质的量是______mol;若将生成的气体通入NaOH溶液中,气体被完全吸收,产物只有NaNO3、NaNO2和H2O,则生成NaNO2的物质的量是______mol.
解:(1)由关系式Cu~CuO~ O2~2HNO3,得n(O2)=n(Cu)×
O2~2HNO3,得n(O2)=n(Cu)× =
=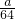 mol×
mol× =
=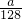 mol,
mol,
n(HNO3)=2n(Cu)=2×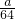 mol=
mol=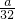 mol,
mol,
故答案: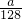 mol;
mol;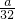 mol;
mol;
(2)①由N原子守恒,得 消耗n(HNO3)=n(NO3-)+n(NO+NO2)=2n(Cu)+n(NO+NO2)=(2×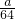 +
+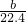 )mol. ②整个过程:完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了
)mol. ②整个过程:完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了
根据得失电子守恒:n(Cu)×2=n(O2)×4,即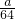 mol×2=n(O2)×4,解得 n(O2)=
mol×2=n(O2)×4,解得 n(O2)=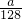 mol,
mol,
③整个过程:只有Cu的化合价和HNO3中部分N原子的化合价发生变化,即Cu失去的电子都被部分HNO3得到了,
则n(NaNO2)×2=n(Cu)×2,解得n(NaNO2)=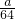 mol,
mol,
故答案:(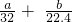 );
);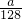 ;
;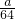 .
.
分析:(1)根据关系式Cu~CuO~ O2~2HNO3来计算;
O2~2HNO3来计算;
(2)根据N原子守恒求得HNO3;根据电子得失守恒求出O2、NaNO2的物质的量;
点评:本题主要考查了质量守恒,电子得失守恒,运用守恒来解题比较方便,但掌握起来有一定的难度.
 O2~2HNO3,得n(O2)=n(Cu)×
O2~2HNO3,得n(O2)=n(Cu)× =
=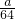 mol×
mol× =
=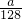 mol,
mol,n(HNO3)=2n(Cu)=2×
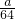 mol=
mol=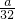 mol,
mol,故答案:
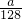 mol;
mol;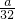 mol;
mol; (2)①由N原子守恒,得 消耗n(HNO3)=n(NO3-)+n(NO+NO2)=2n(Cu)+n(NO+NO2)=(2×
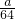 +
+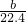 )mol. ②整个过程:完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了
)mol. ②整个过程:完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了根据得失电子守恒:n(Cu)×2=n(O2)×4,即
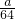 mol×2=n(O2)×4,解得 n(O2)=
mol×2=n(O2)×4,解得 n(O2)=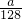 mol,
mol,③整个过程:只有Cu的化合价和HNO3中部分N原子的化合价发生变化,即Cu失去的电子都被部分HNO3得到了,
则n(NaNO2)×2=n(Cu)×2,解得n(NaNO2)=
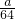 mol,
mol,故答案:(
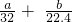 );
);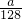 ;
;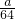 .
.分析:(1)根据关系式Cu~CuO~
 O2~2HNO3来计算;
O2~2HNO3来计算; (2)根据N原子守恒求得HNO3;根据电子得失守恒求出O2、NaNO2的物质的量;
点评:本题主要考查了质量守恒,电子得失守恒,运用守恒来解题比较方便,但掌握起来有一定的难度.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目