题目内容
某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确的是
| A.该化合物仅含碳、氢两种元素 | B.该化合物中碳、氢原子个数比为1:2 |
| C.无法确定该化合物是否含有氧元素 | D.该化合物中一定含有氧元素 |
D
试题分析:有机物燃烧生成8.8gCO2和5.4gH2O,则一定含有C、H元素,
其中n(CO2)=8.8g÷44g/mol=0.2mol,n(C)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,
n(H2O)=5.4g÷18g/mol=0.3mol,n(H)=0.6mol,m(H)=0.6g,
且n(C):n(H)=0.2mol:0.6mol=1:3,
由于2.4g+0.6g=3.0g<6.4g,
则一定含有氧元素,
故选D。
点评:本题考查有机物分子的元素组成,题目难度不大,本题注意有机物完全燃烧只生成二氧化碳和水,一定含有C、H元素,可能含有O元素,从质量守恒的角度判断是否含有氧元素。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
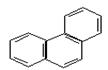
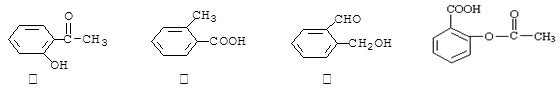
 有两种一氯取代物,则
有两种一氯取代物,则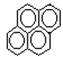 的一氯取代物有
的一氯取代物有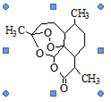
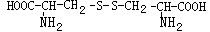
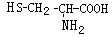 ,则下列说法错误的是
,则下列说法错误的是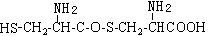
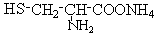 可与NaOH溶液反应放出一种碱性气体
可与NaOH溶液反应放出一种碱性气体