题目内容
高温下硫酸亚铁发生如下反应:2FeSO4 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
| A.BaSO3和BaSO4 | B.BaS | C.BaSO3 | D.BaSO4 |
D
解析试题分析:SO3+ H2O= H2SO4。在酸性环境中SO2不能溶解。H2SO4+BaCl2= BaSO4↓+2HCl.所以得到的沉淀为BaSO4。因此选项为D。
考点:考查SO2与SO3的混合气体通入BaCl2溶液中产生沉淀的情况。

练习册系列答案
相关题目
下列说法正确的是
| A.混合物的分离是依据混合物中各组分性质的差异进行的,元素分析仪、红外光谱仪、原子吸收光谱仪等均是分离物质的常用仪器。 |
| B.道尔顿、汤姆生、卢瑟福、玻尔、阿伏加德罗等科学家在原子结构的认识上作出了重大贡献,他们主要采用的是定量研究和实验研究的方法。 |
| C.煤和石油的综合利用中煤的气化、煤的液化和石油的分馏是物理变化,石油的裂化和裂解、煤的干馏是化学变化 |
| D.某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是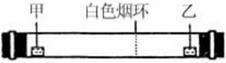
| A.甲是浓氨水,乙是浓硫酸 |
| B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓盐酸 |
| D.甲是浓硝酸,乙是浓氨水 |
光导纤维传输信息容量大,而且抗干扰、防窃听,光导纤维的主要成分是
| A.晶体硅 | B.二氧化硅 | C.硅酸盐 | D.铝硅合金 |
经氯气消毒的自来水,若用于配制以下溶液,会使配制的溶液变质的是
①NaOH;②AgNO3;③Na2CO3;④FeSO4;⑤KI;⑥Na2S;⑦Na2SO3
| A.全部 | B.②④⑤⑥ | C.②⑤ | D.④⑥ |
下列实验正确且能达到目的是
A.溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是加入NaI晶体 HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是加入NaI晶体 |
| B.在温水瓶中加入Na2CO3溶液泡浸后加入盐酸能除去内壁CaSO4 |
| C.用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 |
| D.亚硫酸钠具有较强的还原性,检验亚硫酸钠试样是否变质: |

将足量的SO2通入下列各溶液中,所含离子还能大量共存的是
| A.K+、SiO32-、Cl-、NO3- |
| B.H+、NH4+、Al3+、SO42- |
| C.Na+、Cl-、MnO4-、SO42- |
| D.Na+、CO32-、CH3COO-、HCO3- |
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是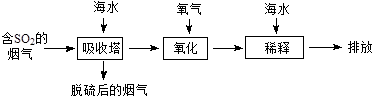
| A.海水pH约为8的原因主要是天然海水含CO32-、HCO3- |
B.吸收塔中发生的反应有SO2+H2O H2SO3 H2SO3 |
| C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42- |
| D.经稀释“排放”出的废水中,SO42-浓度与海水相同 |
已知HNO2在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。
| pH范围 | >7 | <7 |
| 产物 | NO3- | NO、N2O、N2中的一种 |
下列有关说法错误的是( )。
A.碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-=NO3-+Cl-
B.向冷的NaNO2溶液中通入CO2可得到HNO2
C.向冷的NaNO2溶液中加入稀硫酸可得到HNO2
D.向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色