题目内容
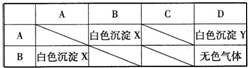 现有四个无标签的试剂瓶,分别盛有硫酸、BaCl2溶液、盐酸和不知名称的某正盐溶液M,将四种试剂分别标为A、B、C、D,取少量试剂分别进行实验得到如表格所示关系(其中无色气体能使澄清石灰水变浑浊,M溶液进行焰色反应为黄色).
现有四个无标签的试剂瓶,分别盛有硫酸、BaCl2溶液、盐酸和不知名称的某正盐溶液M,将四种试剂分别标为A、B、C、D,取少量试剂分别进行实验得到如表格所示关系(其中无色气体能使澄清石灰水变浑浊,M溶液进行焰色反应为黄色).(1)写出试剂名称:A
(2)写出生成X的离子方程式:
(3)有人认为M是Na2C03,此结论是否正确?
(4)若A、硝酸、D三种溶液混合后仍有沉淀,则其反应的离子方程式为
分析:由B与D反应产生无色气体及气体的性质和已有物质组成知,B是盐酸或硫酸、D是碳酸盐或亚硫酸盐,再结合A与B反应能生成沉淀知B只能是硫酸,A是BaCl2溶液,A、硝酸、D三种溶液混合后能得到沉淀,此种沉淀是BaSO4,则M应该是Na2SO3,以此解答该题.
解答:解:由B与D反应产生无色气体及气体的性质和已有物质组成知,B是盐酸或硫酸、D是碳酸盐或亚硫酸盐,再结合A与B反应能生成沉淀知B只能是硫酸,A是BaCl2溶液,A、硝酸、D三种溶液混合后能得到沉淀,此种沉淀是BaSO4,则M应该是Na2SO3,
(1)由以上分析可知A为氯化钡溶液,B为硫酸,故答案为:氯化钡溶液;硫酸;
(2)硫酸和氯化钡反应生成硫酸钡沉淀,反应的离子方程式为SO42-+Ba2+=BaSO4↓,
故答案为:SO42-+Ba2+=BaSO4↓;
(3)M为Na2C03或Na2SO3,因亚硫酸钠与硫酸反应生成的SO2也能使澄清石灰水变浑浊,
故答案为:不正确;亚硫酸钠与硫酸反应生成的SO2也能使澄清石灰水变浑浊;
(4)亚硫酸根离子,在酸性条件下可被硝酸氧化生成硫酸根离子,进而与钡离子反应生成硫酸钡沉淀,反应的离子方程式为3SO32-+2H++2NO3-+3Ba2+=3BaSO4↓+2NO↑+H2O,故答案为:3SO32-+2H++2NO3-+3Ba2+=3BaSO4↓+2NO↑+H2O.
(1)由以上分析可知A为氯化钡溶液,B为硫酸,故答案为:氯化钡溶液;硫酸;
(2)硫酸和氯化钡反应生成硫酸钡沉淀,反应的离子方程式为SO42-+Ba2+=BaSO4↓,
故答案为:SO42-+Ba2+=BaSO4↓;
(3)M为Na2C03或Na2SO3,因亚硫酸钠与硫酸反应生成的SO2也能使澄清石灰水变浑浊,
故答案为:不正确;亚硫酸钠与硫酸反应生成的SO2也能使澄清石灰水变浑浊;
(4)亚硫酸根离子,在酸性条件下可被硝酸氧化生成硫酸根离子,进而与钡离子反应生成硫酸钡沉淀,反应的离子方程式为3SO32-+2H++2NO3-+3Ba2+=3BaSO4↓+2NO↑+H2O,故答案为:3SO32-+2H++2NO3-+3Ba2+=3BaSO4↓+2NO↑+H2O.
点评:本题考查物质的检验及鉴别的实验方案的设计,侧重于物质的性质的考查,注意把握物质的性质,根据反应的现象进行推断,题目难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
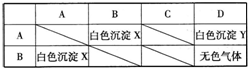 现有四个无标签的试剂瓶,分别盛有硫酸、BaCl2溶液、盐酸和不知名称的某正盐溶液M,将四种试剂分别标为A、B、C、D,取少量试剂分别进行实验得到如表格所示关系(其中无色气体能使澄清石灰水变浑浊,M溶液进行焰色反应为黄色).
现有四个无标签的试剂瓶,分别盛有硫酸、BaCl2溶液、盐酸和不知名称的某正盐溶液M,将四种试剂分别标为A、B、C、D,取少量试剂分别进行实验得到如表格所示关系(其中无色气体能使澄清石灰水变浑浊,M溶液进行焰色反应为黄色).