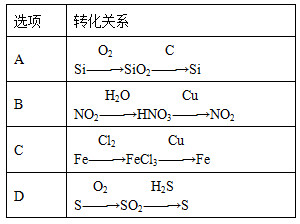
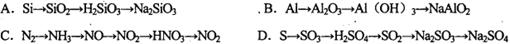题目内容
室温下,将0.1mol/L的H2 SO4溶液分别缓慢注入以下四种浓度均为0.1mol/L的溶液,各指标随加人H2 SO4溶液体积变化曲线图错误的是
A、D
解析试题分析:A. 向NaAlO2溶液中加入H2SO4,首先发生反应:2NaAlO2+ H2SO4+2H2O= Na2SO4+2Al(OH)3↓.当H2SO4过量时又发生:3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O .前后消耗的硫酸的体积比为1:3.错误。B.向Na2CO3溶液中加入硫酸时首先发生反应:2Na2CO3+ H2SO4= Na2SO4+ 2NaHCO3;然后发生反应2NaHCO3+ H2SO4= Na2SO4+ H2O+ CO2↑。当溶液中所有生成的NaHCO3完全反应转化为Na2SO4时气体体积达到最大值,再加入硫酸也不产生气体。正确。C.氨水呈碱性,溶液的pH>7,当向溶液中加入H2SO4时发生酸碱中和反应:2NH3·H2O+ H2SO4= (NH4)2SO4+2H2O.当二者恰好发生中和反应时溶液的pH会有一个大的突变,然后就是H2SO4和(NH4)2SO4的混合溶液,显酸性,pH<7正确。D. 对于BaCl2溶液来说电离产生大量的Ba2+和Cl-,所有溶液能导电,当向溶液中加入H2SO4时,发生反应:BaCl2+ H2SO4=BaSO4↓+2HCl。溶液中导电的微粒为H+和Cl-.一个Ba2+的导电性与2个H+的导电能力相同,但由于溶液的体积增大,所以自由移动的离子的浓度减小,溶液的导电能力减弱。错误。
考点:考查物质的量的多少对化学反应的影响的知识。

 阅读快车系列答案
阅读快车系列答案下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液
②过量NaOH溶液和明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液
④Na2O2投入FeCl3溶液
| A.①④ | B.②③④ | C.②③ | D.①③④ |
下列物质 ①NaHCO3 ②Al(OH)3 ③K2SO4 ④(NH4)2CO3中,既能与盐酸反应,又能与氢氧化钠溶液反应的是
| A.只有②④ | B.①③④ | C.①②④ | D.全部 |
下列四组反应中既有白色沉淀产生,又有气体放出的是
| A.Na2O2和CuSO4溶液反应 | B.金属钠投入到MgSO4溶液中 |
| C.BaCl2和NaHSO4溶液反应 | D.纯碱溶液和澄清石灰水反应 |
下列物质间的转化关系中不能全部通过一步反应完成的是
| A.Na→NaOH→Na2CO3→NaCl | B.Mg→MgCl2→MgCO3→Mg(OH)2 |
| C.Al→Al2O3→Al(OH)3→AlCl3 | D.Fe→FeCl3→Fe(OH)3→Fe2O3 |
下列各项叙述I、Ⅱ都正确且二者的原理最相似的是
| | 叙述I | 叙述Ⅱ |
| A | FeS难溶于水,却溶于稀硝酸 | CaCO3难溶于稀硫酸,却溶于醋酸 |
| B | 浓硝酸要密封保存阴凉处 | 漂白粉要密封保存在阴凉处 |
| C | 盐酸与铁反应生成氯化亚铁 | 少量氯气与铁反应生成氯化亚铁 |
| D | 碳酸钠溶液显弱碱性 | 氯化铵溶液显弱酸性 |
下列说法正确的是( )
| A.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 |
| B.Si、P、S、Cl相应的最高价氧化物对应的水化物的酸性依次增强 |
| C.工业上通常用电解钠、铁、铜对应的氯化物制得这3种金属单质 |
| D.金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步进行 |