题目内容
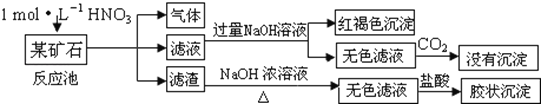
【题目】欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如图所示.已知:碳酸不能溶解Al(OH)3沉淀.
(1)Si在周期表中的位置是 .
(2)下列说法正确的是 .
a.酸性:H2CO3>H2SiO3b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4d.离子半径:O2﹣<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 .
(4)该矿石和1mol/LHNO3反应的离子方程式 .
【答案】(1)第三周期、ⅣA族;(2)abc;
(3)FeCO3和SiO2;SiO2+2OH﹣=SiO32﹣+H2O;
(4)3FeCO3+10H++NO3﹣=3Fe3++3CO2↑+NO↑+5H2O;
【解析】试题分析:(1)Si是14号元素,在周期表中的位置是第三周期、ⅣA族;(2)a.同主族元素从上到下非金属性减弱,最高价含氧酸酸性减弱:H2CO3>H2SiO3,a正确;b.同周期半径从左到右减小,同主族半径从上到下增大,原子半径:O<C<Si<Al,b正确;同主族元素从上到下非金属性减弱,同周期从左到右非金属性增强,非金属性越强气态氢化物越稳定,稳定性:H2O>CH4>SiH4,c正确;d.层数越多半径越大,同层序数越大半径越小,离子半径:O2﹣>Al3+,d错误;(3)矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,加盐酸生成气体为二氧化碳,则一定含FeCO3;加盐酸后的滤渣为SiO2,胶状沉淀为硅酸;结合转化关系可知,滤液中含氯化亚铁、氯化铝、盐酸,反应①中加足量碱,生成白色沉淀为Fe(OH)2,红褐色沉淀为Fe(OH)3,则氧化物I为Fe2O3;通二氧化碳没有沉淀,无色滤液中不含NaAlO2,则氧化物无为Al2O3,由上述分析可知,矿石中含FeCO3、SiO2;SiO2和NaOH溶液反应生成硅酸钠和水的离子方程式是SiO2+2OH﹣=SiO32﹣+H2O;(4)该矿石中含有+2价的铁, 1mol/LHNO3反应生成+3价铁的离子方程式3FeCO3+10H++NO3﹣=3Fe3++3CO2↑+NO↑+5H2O;。
