题目内容
【题目】根据问题填空:
(1)机智如化学老师的你用固体烧碱配制500mL0.20molL﹣1的NaOH溶液,需要称取g固体,定容时除了胶头滴管和玻璃棒,还需要的仪器为 .
(2)语文老师要用36.5%(ρ=1.18gcm﹣3 )的浓盐酸配制0.4molL﹣1的盐酸240mL,需准确量取36.5%的浓盐酸mL.
(3)若配制0.5molL﹣1的硫酸溶液的其他操作均正确,但出现下列错误操作,下列所配制的硫酸溶液浓度偏低的是(填序号).
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒.
B.移液时容量瓶中有少量蒸馏水.
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切.
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切.
E.稀释后没冷却到室温就将溶液转移至容量瓶.
【答案】
(1)4.0;500mL容量瓶
(2)8.5
(3)AC
【解析】解:(1)配制500mL0.20molL﹣1的NaOH溶液,需要溶质的质量为:0.5L×0.2mol/L×40g/mol=4.0g;
定容时,用胶头滴管逐滴滴加蒸馏水到凹液面最低处与刻度线相切,用到的仪器:500mL容量瓶、胶头滴管、玻璃棒,缺少的仪器:500mL容量瓶;
所以答案是:500mL容量瓶;(2)36.5%(ρ=1.18gcm﹣3 )的浓盐酸物质的量浓度C= ![]() =11.8mol/L,配制0.4molL﹣1的盐酸240mL,应选择250mL容量瓶,实际配制250mL溶液,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变计得:250mL×0.4molL﹣1=11.8mol/L×V,解得V=8.5mL;
=11.8mol/L,配制0.4molL﹣1的盐酸240mL,应选择250mL容量瓶,实际配制250mL溶液,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变计得:250mL×0.4molL﹣1=11.8mol/L×V,解得V=8.5mL;
所以答案是:8.5;(3)A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A选;
B.移液时容量瓶中有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B不选;
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故C选;
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切,导致溶液体积偏小,溶液浓度偏高,故D不选;
E.稀释后没冷却到室温就将溶液转移至容量瓶,冷却后溶液体积偏小,溶液浓度偏高,故E不选;
故选:AC.
【考点精析】掌握配制一定物质的量浓度的溶液是解答本题的根本,需要知道配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.

 名校课堂系列答案
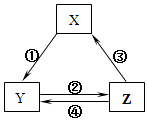
名校课堂系列答案【题目】表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
B | Na | Na2O2 | NaCl | ②加H2O |
C | NO | NO2 | HNO3 | ③与C加热 |
D | Al2O3 | NaAlO2 | Al(OH)3 | ④与NaOH |
A.A
B.B
C.C
D.D




