题目内容
把mmolC2H4和nmolH2混合于密闭容器中,在适当的条件下,反应达到平衡时生成pmolC2H6,若将所得平衡混合气完全燃烧生成CO2和H2O,需要氧气( )
| A.(3m+3n)mol | B.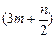 mol mol | C.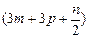 mol mol | D.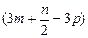 mol mol |
B。
法一:先求出达到平衡后,平衡混合气体的成分及物质的量,然后求出这些物质分别燃烧时分别消耗氧气的物质的量,再求出氧气的总物质的量。
C2H4 + H2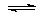 C2H6
C2H6
起始: m n 0
转化: p p p
平衡: m-p n-p p
以上三种物质燃烧时消耗氧气的总物质的量为3(m-p)+0.5(n-p)+3.5p=(3m+0.5n)mol。
法二:由化学反应实质及质量守恒定律可知,反应前后原子的种类和个数不变,所以反应后各物质的量燃烧时消耗氧气的量等于反应前C2H4和H2燃烧时耗氧的总量。即平衡混合物燃烧时耗氧总量=(3m+0.5n)mol。
C2H4 + H2
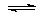 C2H6
C2H6起始: m n 0
转化: p p p
平衡: m-p n-p p
以上三种物质燃烧时消耗氧气的总物质的量为3(m-p)+0.5(n-p)+3.5p=(3m+0.5n)mol。
法二:由化学反应实质及质量守恒定律可知,反应前后原子的种类和个数不变,所以反应后各物质的量燃烧时消耗氧气的量等于反应前C2H4和H2燃烧时耗氧的总量。即平衡混合物燃烧时耗氧总量=(3m+0.5n)mol。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目