题目内容
2.下列说法正确的是( )| A. | HOCH2COOH既可发生取代反应,也可发生加聚反应 | |
| B. | 某有机化合物完全燃烧生成等物质的量的CO2和H2O,则该有机物的分子式一定CnH2n | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| D. | 酸性条件下CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
分析 A、含有醇羟基和羧基的有机物的性质来回答判断;
B、生成CO2和H2O的物质的量相等,则该烃碳氢原子个数比是1:2;
C、二甲醚(CH3OCH3)和乙醇(CH3CH2OH)分子式相同,是同分异构体;
D、在酸性条件下,CH3CO18OC2H5的水解产物是羧酸和醇,根据酯化反应的原理:酸掉羟基醇掉氢的原理来回答.
解答 解:A、HOCH2COOH中含有醇羟基和羧基,可以发生取代反应和酯化反应,不能发生加聚反应,故A错误;
B、生成CO2和H2O的物质的量相等,则该烃碳氢原子个数比是1:2,则该有机物的分子式不一定CnH2n,可能含有氧元素,故B错误;
C、甲烷、甲醛、甲酸都不存在同分异构体,但是二甲醚(CH3OCH3)和乙醇(CH3CH2OH)分子式相同,是同分异构体,故C错误;
D、在酸性条件下,CH3CO18OC2H5的水解反应是酯化反应的逆反应,酯化反应的原理:酸掉羟基醇掉氢的原理,所以CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH,故D正确.
故选D.
点评 本题涉及有机物分子式的确定、同分异构体的书写、有机物的性质等知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
12.下列反应中,不属于取代反应的是( )
| A. | 乙醇与金属钠的反应 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 实验室制乙炔 |
10.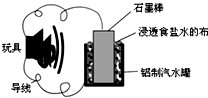 利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )
利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )
 利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )
利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )| A. | 铝罐将逐渐被腐蚀 | |
| B. | 该电池驱动电动玩具时,石墨棒应与玩具电机的负极相连 | |
| C. | 石墨棒上发生的反应为:O2-4e-+2H2O═4OH- | |
| D. | 该电池工作一段时间后石墨棒的质量会减轻 |
17. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:R>T |
7.某元素最高价氧化物对应水化物的化学式是H2XO3,这种元素的气态氢化物的分子式为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
14.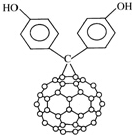 由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
 由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )| A. | C60的二苯酚基化合物属于芳香烃 | |
| B. | C60的二苯酚基化合物分子式为C73H12O2 | |
| C. | C60的二苯酚基化合物能与氢氧化钠溶液反应 | |
| D. | 1mol C60的二苯酚基化合物最多可以与6mol H2发生加成反应 |

 ;
; +(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+
+(CH3)2CHCH2OH$?_{△}^{浓硫酸}$H2O+ ;
;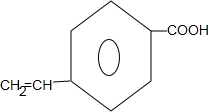 .
.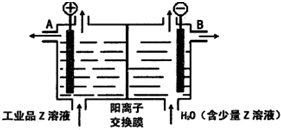 A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素.A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6.请回答下列问题:
A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素.A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6.请回答下列问题: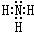 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.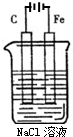 如图是电解NaCl溶液的示意图.请回答下列问题:
如图是电解NaCl溶液的示意图.请回答下列问题: