题目内容
【题目】把V L含有Na2SO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使Al3+完全转化为AlO2-;另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4。则原混合溶液中Na+的浓度为( )
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
【答案】A
【解析】
试题分析:混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=bmol,另一份加氢氧化钠溶液时发生Al3++4OH-=AlO2-+2H2O,由方程式可知每份溶液中n(Al3+)=![]() n(OH-)=
n(OH-)=![]() amol,由电荷守恒可知每份中3n n(Al3+)+n(Na+)=2n(SO42-),故每份中溶液n(Na+)=2bmol-3×
amol,由电荷守恒可知每份中3n n(Al3+)+n(Na+)=2n(SO42-),故每份中溶液n(Na+)=2bmol-3×![]() amo,故原溶液中钠离子浓度=
amo,故原溶液中钠离子浓度=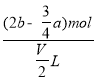 =
=![]() mol/L,答案选A。
mol/L,答案选A。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目