题目内容
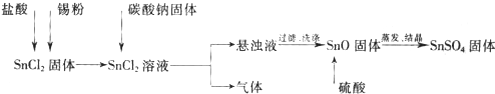
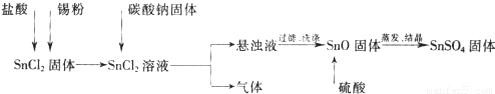
酸性条件下,锡元素在水溶液中有Sn2+、Sn4+两种主要存在形式.SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业.实验中制备SnSO4的流程如下:
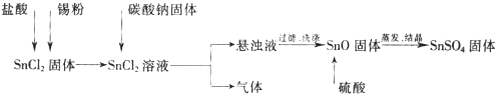
(1)碳酸钠与SnCl2反应的化学方程式为______.
(2)制取SnSO4时,需加入稍过量的H2SO4,除溶角SnO外,其另一作用是______.
(3)酸性条件下,SnSO4可以用作双氧水去除剂,反应的离子方程式为______.
(4)镀锡与镀锌是铁件防锈的常用方法.铁件电镀锡时,接直流电源正极的电极材料是______;镀锡铁发生吸氧腐蚀的正极反应式为______.
解:(1)碳酸钠与SnCl2反应生成氧化亚锡、二氧化碳和氯化钠,反应的化学方程式为:SnCl2+Na2CO3=SnO+CO2↑+2NaCl,故答案为:SnCl2+Na2CO3=SnO+CO2↑+2NaCl;
(2)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入硫酸,使该平衡向左移动,抑制Sn2+水解,故答案为:抑制Sn2+水解;
(3)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(4)铁件电镀锡时,镀件铁锡做阴极,镀层金属作阳极,电镀液是含有锡离子的盐,所以接直流电源正极的电极材料是金属锡,镀锡铁发生吸氧腐蚀的正极反应是氧气发生得电子的还原反应,即O2+2H2O+4e-=4OH-,故答案为:Sn;O2+2H2O+4e-=4OH-.
分析:(1)碳酸钠与SnCl2反应生成氧化亚锡、二氧化碳和氯化钠,据此书写化学方程式;
(2)SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)酸性条件下,SnSO4可以和双氧水之间发生氧化还原反应生成硫酸锡和水,根据离子方程式的书写方法来回答;
(4)铁件电镀锡时,镀件做阴极,镀层金属作阳极,电镀液是含有锡离子的盐,根据电解原理和金属的吸氧腐蚀原理来回答.
点评:本题考查学生电解池的工作原理以及金属的吸氧腐蚀原理知识,注意知识的迁移和应用是解题关键,难度不大.
(2)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入硫酸,使该平衡向左移动,抑制Sn2+水解,故答案为:抑制Sn2+水解;
(3)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(4)铁件电镀锡时,镀件铁锡做阴极,镀层金属作阳极,电镀液是含有锡离子的盐,所以接直流电源正极的电极材料是金属锡,镀锡铁发生吸氧腐蚀的正极反应是氧气发生得电子的还原反应,即O2+2H2O+4e-=4OH-,故答案为:Sn;O2+2H2O+4e-=4OH-.
分析:(1)碳酸钠与SnCl2反应生成氧化亚锡、二氧化碳和氯化钠,据此书写化学方程式;
(2)SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)酸性条件下,SnSO4可以和双氧水之间发生氧化还原反应生成硫酸锡和水,根据离子方程式的书写方法来回答;
(4)铁件电镀锡时,镀件做阴极,镀层金属作阳极,电镀液是含有锡离子的盐,根据电解原理和金属的吸氧腐蚀原理来回答.
点评:本题考查学生电解池的工作原理以及金属的吸氧腐蚀原理知识,注意知识的迁移和应用是解题关键,难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目