题目内容
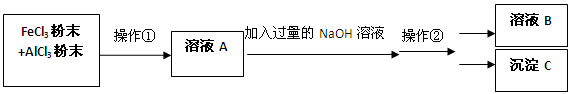
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为多少?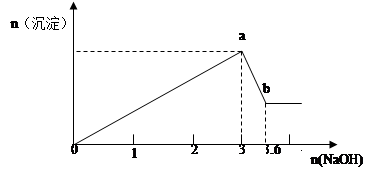
FeCl3、AlCl3的物质的量浓度各为4mol/L、6mol/L(要写出规范的计算过程)
解析试题分析:由Fe3+ + 3OH- = Fe(OH)3↓ Al3+ + 3OH- =Al(OH)3↓得当所有Fe3+和 Al3+都沉淀完全时,,达到最大沉淀量a,消耗OH-3mol,即FeCl3、AlCl3共1mol
继续加NaOH,Al(OH)3逐渐溶解,Al(OH)3 + OH- =AlO2- +H2O
消耗OH-共0.6mol。所以可以由原子守恒得出AlCl3的物质的量为0.6mol,所以FeCl3物质的量为0.4mol。
c(FeCl3)=n/V=0.4mol/0.1L=4mol/L,c(AlCl3)=n/V=0.6mol/0.1L=6mol/L。
考点:氢氧化钠和氯化铝的反应
点评:在此总结一下对于图象问题的分析方法:(1)认清坐标系,搞清纵、横坐标所代表的意义。(2)看清起点、拐点、终点,看清曲线的变化趋势,并弄清楚各点的物理意义。

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.