题目内容
3.下列排列顺序中错误的为( )| A. | 原子半径:O<S<Na | B. | 稳定性 PH3<H2S<NH3 | ||
| C. | 电负性P<S<Cl | D. | 第一电离能Na<Mg<Al |
分析 A.同周期元素原子半径依次减小,同主族从上到下依次增大;
B.元素的非金属性越强,其气氢化物的热稳定性越强;
C.元素的非金属性越强,电负性越强;
D.同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.
解答 解:A.同周期元素原子半径依次减小,同主族从上到下依次增大,所以半径:O<S<Na,故A正确;
B.元素的非金属性越强,其气氢化物的热稳定性越强,非金属性:N>S>P,所以稳定性PH3<H2S<NH3,故B正确;
C.元素的非金属性越强,电负性越强,元素的非金属性:P<S<Cl,所以电负性P<S<Cl,故C正确;
D.同一周期元素的第一电离能随着原子序数的增大而增大,同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的,所以第一电离能Na<Al<Mg,故D错误;故选D.
点评 本题考查了元素金属性、非金属性的判断依据、元素性质的递变规律,题目难度小属于基础题,注意理解并记住相应的递变规律.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列化学实验能达到目的是( )
| A. | 用激光笔检验某KI溶液中是否溶有淀粉 | |
| B. | 加热可除去NaHCO3固体中的Na2CO3杂质 | |
| C. | 向碘水中加入苯或酒精,均可从碘水中萃取碘 | |
| D. | 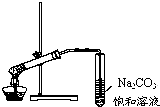 用如图所示的装置制取少量的乙酸乙酯 |
14.下列表述正确的是( )
| A. | 羟基的电子式: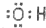 | B. | 1-丁烯的键线式  | ||
| C. | 醛基的结构简式-COH | D. | 聚丙烯的结构简式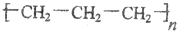 |
11.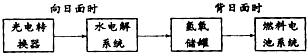 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可以循环的 | |
| B. | 燃料电池系统产生的能量实际上来自于水 | |
| C. | 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ | |
| D. | 燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
18.下列溶液中的c(Cl-)与50mL 1mol/L的氯化铝溶液中c(Cl-)相等的是( )
| A. | 150 mL 1 mol/L的NaCl溶液 | B. | 75 mL 2 mol/L的NH4Cl溶液 | ||
| C. | 150 mL 3 mol/L的KCl溶液 | D. | 75 mL 1 mol/L的BaCl2溶液 |
8.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 仅由非金属元素组成的化合物可以是离子化合物 | |
| B. | 普通陶瓷、玻璃、水泥是使用量大的材料,其生产都采用含硅元素的原料 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应 |
15.下列物质中,不属于合金的是( )
| A. | 18K金 | B. | 青铜 | C. | 钢 | D. | 水银 |
12.下列关于物质的类别的说法不正确的是( )
| A. | 能在水溶液或熔融状态下导电的物质就是电解质 | |
| B. | 胶体是一种能产生丁达尔效应的分散系 | |
| C. | 纯碱不属于碱,干冰属于酸性氧化物 | |
| D. | Na2O和Na2O2都能与水反应生成对应的碱,它们都是碱性氧化物 |
 和
和 ⑧CH3CH2CH2CH3 和CH3CH2CH(CH3)2
⑧CH3CH2CH2CH3 和CH3CH2CH(CH3)2