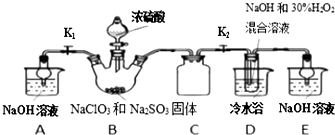
题目内容
11.常温下,下列溶液中的微粒浓度关系正确的是( )| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO${\;}_{3}^{-}$)>c(CO${\;}_{3}^{2-}$)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH${\;}_{4}^{+}$)>c(OH-)=c(H+) | |
| D. | 0.1mol•L-1 CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH) |
分析 A.依据溶液中电荷守恒分析判断;
B.碳酸氢钠溶液中碳酸氢根离子水解大于电离;
C.氨水存在电离平衡盐酸反应完全,一水合氨又电离出氢氧根离子和铵根离子;
D.反应后生成醋酸钠,根据物料守恒判断.
解答 解:A.新制氯水中加入固体NaOH所以生成次氯酸钠、氯化钠、水:溶液中存在电荷守恒c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;
B.碳酸氢钠溶液中碳酸氢根离子水解大于电离,pH=8.3的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.氨水存在电离平衡盐酸反应完全,一水合氨又电离出氢氧根离子和铵根离子,溶液呈碱性溶液中离子浓度大小为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.0.1mol•L-1 CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合,恰好反应生成醋酸钠,根据物料守恒可得:c(Na+)=c(CH3COO-)+c(CH3COOH),故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高考高频点,正确判断溶液中溶质及其物质的量,再结合溶液酸碱性、原子守恒、电荷守恒分析解答即可,注意掌握电荷守恒、物料守恒的含义.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
1.下列反应中水只作氧化剂的是( )
| A. | 2Na+2H2O═2NaOH+H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O |
2.下列文字表述与反应方程式对应且正确的是( )
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用新制Cu(OH)2悬浊液检验乙醛中醛基:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$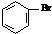 +HBr +HBr | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
19.下列实验方法不正确的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用溴水检验汽油中是否含有不饱和脂肪烃 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用蒸馏的方法可以分离醋酸与乙醇的混合物 |
6.下列实验方案中,可行的是( )
| A. | 加稀盐酸后过滤,可除去混在镁粉中的少量铝粉 | |
| B. | 用萃取的方法分离汽油和煤油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体混合物 | |
| D. | 用渗析的方法可除去氢氧化铁胶体中的氯化铁 |
16.铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl2•2H2O),为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
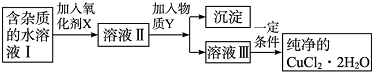
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
(1)最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离.
(3)加入的物质Y是CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3(写化学式),目的是调节溶液的pH.根据信息,溶液的pH范围应为调节溶液的pH至4~4.7.
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=1×10-35.
(5)结合方程式和必要文字说明解释不能将溶液Ⅲ直接蒸发结晶得到CuCl2•2H2O晶体的原因CuCl2+2H2O?Cu(OH)2+2HCl温度升高,HCl挥发,水解平衡正向移动,得到Cu(OH)2固体,而无法得到晶体.
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有产生气泡和红褐色沉淀.

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 4 | 9.0 | 6.7 |
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离.
(3)加入的物质Y是CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3(写化学式),目的是调节溶液的pH.根据信息,溶液的pH范围应为调节溶液的pH至4~4.7.
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=1×10-35.
(5)结合方程式和必要文字说明解释不能将溶液Ⅲ直接蒸发结晶得到CuCl2•2H2O晶体的原因CuCl2+2H2O?Cu(OH)2+2HCl温度升高,HCl挥发,水解平衡正向移动,得到Cu(OH)2固体,而无法得到晶体.
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有产生气泡和红褐色沉淀.
3.下列说法不正确的有( )
| A. | NA个氧分子与NA个氢分子的质量比等于16:1 | |
| B. | 标准状况下,22.4 L以任意比混合的氢气和一氧化碳混合物所含原子数为2NA | |
| C. | 标准状况下,0.5NA个H2O分子所占体积约为11.2 L | |
| D. | 16 g O2和O3的混合物中共含有NA个氧原子 |
20.下列反应的离子方程式中正确的是( )
| A. | Na2CO3溶液与Ba(OH)2溶液反应CO32-+Ba2+=BaCO3↓ | |
| B. | NaOH溶液与CH3COOH溶液反应H++OH-═H2O | |
| C. | NaHCO3溶液与盐酸反应CO32-+2H+=CO2↑+H2O | |
| D. | NaHCO3溶液与CaCl2溶液反应CO32-+Ca2+=CaCO3↓ |