题目内容
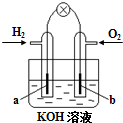 燃料电池是目前电池研究的热点之一.现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极.下列叙述不正确的是( )
燃料电池是目前电池研究的热点之一.现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极.下列叙述不正确的是( )分析:氢氧燃料电池工作时,通入氢气的一极(a极)为电池的负极,发生氧化反应,通入氧气的一极(b极)为电池的正极,发生还原反应,电子由负极经外电路流向正极,负极反应为:H2-2e-+2OH-=2H2O,正极反应为:O2+4e-+2H2O=4OH-,总反应方程式为2H2+O2=2H2O.
解答:解:A.氢氧燃料电池工作时,通入氢气的一极(a极)为电池的负极,发生氧化反应,故A正确;
B.通入氧气的一极(b极)为电池的正极,发生还原反应,正极反应为:O2+4e-+2H2O=4OH-,故B错误;
C.氢氧燃料电池的电池总反应方程式与氢气在氧气中燃烧的化学方程式一致,都是2H2+O2=2H2O,故C正确;
D.总反应方程式为2H2+O2=2H2O,电池工作时生成水,c(OH-)减小,则PH减小,故D正确.
故选B.
B.通入氧气的一极(b极)为电池的正极,发生还原反应,正极反应为:O2+4e-+2H2O=4OH-,故B错误;
C.氢氧燃料电池的电池总反应方程式与氢气在氧气中燃烧的化学方程式一致,都是2H2+O2=2H2O,故C正确;
D.总反应方程式为2H2+O2=2H2O,电池工作时生成水,c(OH-)减小,则PH减小,故D正确.
故选B.
点评:本题考查原电池的工作原理,题目难度中等,注意电极反应时的书写以及电解质溶液离子浓度的变化,为该题的易错点.

练习册系列答案
相关题目