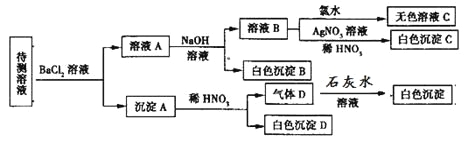
题目内容
【题目】NA为阿伏伽德罗常数,下列说法不正确的是
A.常温常压下,28gCO和N2混合气体中含有的原子总数为2![]()
B.标准状况下,11.2L的水中含有水分子0.5NA
C.2molOH-中电子数为20NA
D.0.1molFeCl3形成Fe(OH)3胶体,Fe(OH)3胶粒的数目小于0.1![]()
【答案】B
【解析】
试题分析:A.CO和N2的摩尔质量相等,且均为双原子分子,28g的混合气体的物质的量为1mol,含有的原子总数为2NA,故A正确;B.标准状况下水为液体,无法根据气体摩尔体积计算其物质的量,故B错误;C.每个OH-中含有10个电子,2molOH-中电子数为20NA,故B正确;D.0.1molFeCl3形成Fe(OH)3胶体发生的是水解反应,是可逆反应,且Fe(OH)3胶粒是多个Fe(OH)3的聚合体,故D错误,答案为B。

【题目】甲醇是一种绿色能源,是机动车燃油的最佳替代品。请回答下列有关问题:
(1)用CO可以合成甲醇。已知:
ⅰ.CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
ⅱ.CO(g)+ ![]() O2(g)=CO2(g) △H=-283.0 kJmol-1;
O2(g)=CO2(g) △H=-283.0 kJmol-1;
ⅲ.H2(g)+ ![]() O2(g)=H2O(g) △H=-285.8 kJmol-1;
O2(g)=H2O(g) △H=-285.8 kJmol-1;
则 CO(g)+2H2(g)![]() CH3OH(g) △H=________kJ·mol-1。
CH3OH(g) △H=________kJ·mol-1。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
ⅳ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-53.7 kJmol-1平衡常数 K1;
CH3OH(g)+H2O(g) △H=-53.7 kJmol-1平衡常数 K1;
ⅴ.CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.2 kJmol-1平衡常数K2。
CO(g)+H2O(g)△H=+41.2 kJmol-1平衡常数K2。
下列四组实验,若控制CO2和H2初始投料比均为1∶2.2,经过相同反应时间测得如下实验数据:
温度(K) | 催化剂 | CO2转化率(%) |
543 | Cu/ZnO纳米棒材料 | 12.3 |
543 | Cu/ZnO纳米片材料 | 10.9 |
553 | Cu/ZnO纳米棒材料 | 15.3 |
553 | Cu/ZnO纳米片材料 | 12.0 |
①CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=___________(用含K1、K2的表达式表示)。
CH3OH(g)的平衡常数K=___________(用含K1、K2的表达式表示)。
②有利于提高CO2转化为CH3OH平衡转化率的措施有_________。
a.使用Cu/ZnO纳米棒衬料
b.使用Cu/ZnO纳米片材料
c.降低反应温度
d.保持投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
③由表格中的数据可知,相同温度下不同的催化剂对CO2的转化率不同,造成该结果的原因是_________________________________________。
(3)甲醇燃料电池是目前技术最成熟,应用最广泛的一种燃料电池,其工作原理如下图所示:
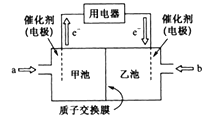
①a气体的名称是_________。
②甲池所在电极为原电池的______极,其电极反应式为__________________________。
③电解液中,H+的移动方向为_____________。