��Ŀ����
��1������Һ�д���3��ƽ����ϵ,�õ��뷽��ʽ�����ӷ���ʽ��ʾ______________��
��2����Һ�ﹲ��__________�ֲ�ͬ�����ӣ�ָ���ӻ����ӣ���
��3������Щ�����У�Ũ��Ϊ0.005mol/L����________��Ũ��Ϊ0.001mol/L����__________��
��4��_________��_________�������ӵ����ʵ���֮�͵���0.005mol��
��5��__________��__________�������ӵ����ʵ���֮�ͱ�������������0.004mol��
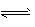 H++CH3COO-�� H2O
H++CH3COO-�� H2O 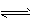 H++OH- �� CH3COO-+H2O
H++OH- �� CH3COO-+H2O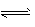 CH3COOH+OH-
CH3COOH+OH- ��2��7
��3��Na+��Cl-
��4��CH3COOH��CH3COO-
��5��CH3COO-��OH-

 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д����ǵ����Ϻ����ḻ��һ��Ԫ�أ���Ԫ�صĵ��ʺͻ������ڹ�ũҵ����������������Ҫ��;��
��1���������������仯ʾ��ͼ��

д��CO��NO2��Ӧ����NO��CO2���Ȼ�ѧ����ʽ
��2���ڹ̶�������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)  2NH3
(g) ��H<0��
2NH3
(g) ��H<0��
��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±������ж�K1 K2���>������=����<����
|
T /K |
298 |
398 |
|
ƽ�ⳣ��K |
K1 |
K2 |
��3�����и�����˵���÷�Ӧ�ﵽƽ��״̬���� ������ĸ��ţ�
a�� v(H2)��=3 v(N2)��
b�� ������ѹǿ���ֲ���
c�� �����л��������ܶȱ��ֲ���
d.�� N2 ��H2��NH3��Ũ��֮��Ϊ1:3:2
��4��������������ˮ,������ͼʵ������֤,�ڱ�״����,��ƿ�еİ�ˮʹ��̪��졣

��ش�
���û�ѧ����˵�����ð�ˮ��ʹ��̪����ԭ�� ��
��250Cʱ����һ�����İ�ˮ�������Ϻ�pH=7����û����Һ��c(Cl-)��c(NH4+)��ϵΪ ������ĸ��ţ�
a��c(Cl-)��c(NH4+) b��c(Cl-)��c(NH4+)
c�� c(Cl-)��c(NH4+) d.���ж�

 2NH3(g)��H<0
2NH3(g)��H<0