题目内容
把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,使它们发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g)
nZ(g)+2W(g)
5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则
(1)上述反应中Z气体的计量系数n的值是( )
A.1 B.2 C.3 D.4
(2)上述反应在5 min末时,已反应掉的Y值占原来的百分比是( )
A.20% B.25% C.33% D.50%
解析:
|
精析:(1)5 min末生成的Z为0.01 mol·(L·min)-1×5 min×2 L=0.1 mol n(Z)∶n(W)=0.1∶0.2=1∶2则n=1 (2)由(1)题知5 min末生成Z为0.1 mol,则知参加反应的Y为0.1 mol,已反应掉的Y值占原来的百分比是: 小结:此题第(1)问属因果倒置型,已知反应速率,反过来求化学计量数,再用此结论解决第(2)问,因此基础识的落实及灵活应用在化学学习中尤为重要. |

碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g) 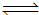 CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
CO(g)
+H2(g) ΔH=
+131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g)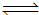 2CO(g)
△H=+172.5kJ•mol-1
2CO(g)
△H=+172.5kJ•mol-1
则CO(g)+H2O(g)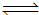 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)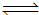 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为:
。
若用该电池提供的电能电解60mL NaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
 CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g)
CO2(g)+H2(g),得到如下数据:
|
温度/℃ |
起始量/mol |
平衡量/mol[学科 |
达到平衡所x需时间/min |
||
|
H2O |
CO |
H2 |
CO |
||
|
900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)
 2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)
ΔH=-92.4kJ•mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
不同实验条件下反应,N2浓度随时间变化如下图1。


图1 图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
 nZ(g)+2W(g), 5 min末已生成0.3 mol W,若测知以Z浓度变化来表示的反应平均速率为0.03 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( )
nZ(g)+2W(g), 5 min末已生成0.3 mol W,若测知以Z浓度变化来表示的反应平均速率为0.03 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( )