题目内容
用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL0.3mol/LNaCl溶液和现300mL0.15mol/L的AgNO3溶液,当甲中产生0.56L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液在室温下的pH为(设混合后总体积为500mL,且所产生的Cl2全部逸出)
- A.2
- B.7
- C.11.7
- D.12
D
考点:电解原理;pH的简单计算.
分析:两个电解池串联,分别发生的反应为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;AgNO3+2H2O
2NaOH+H2↑+Cl2↑;AgNO3+2H2O  4Ag+4HNO3+O2↑,各电极上转移的电子的数目相等,根据生成氢气的物质的量计算两个烧杯中生成酸和碱的物质的量,进而计算混合后溶液的PH.
4Ag+4HNO3+O2↑,各电极上转移的电子的数目相等,根据生成氢气的物质的量计算两个烧杯中生成酸和碱的物质的量,进而计算混合后溶液的PH.
解:两个烧杯中发生的反应分别为:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
4AgNO3+2H2O 4Ag+4HNO3+O2↑,
4Ag+4HNO3+O2↑,
生成氯气的物质的量为:
n(Cl2)=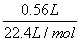 =0.025mol,
=0.025mol,
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
2 1
n(NaOH) 0.025mol
n(NaOH)=0.05mol
两烧杯中含有的n(NaCl)=0.06mol,n(AgNO3)=0.045mol,
以当甲中产生0.56L(标准状况)Cl2时停止电解时,硝酸银完全电解,并进一步电解水,
4AgNO3+2H2O 4Ag+4HNO3+O2↑
4Ag+4HNO3+O2↑
4 4
0.045mol n(HNO3)
n(HNO3)=0.045mol
将两个烧杯混合,碱过量,溶液中过量的OH-离子的物质的量为n(OH-)=0.05mol-0.045mol=0.005mol,
混合后溶液的c(OH-)=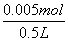 =0.01mol/L,
=0.01mol/L,
c(H+)=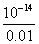 =10-12mol/L,所以PH=12.
=10-12mol/L,所以PH=12.
故选D.
考点:电解原理;pH的简单计算.
分析:两个电解池串联,分别发生的反应为:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;AgNO3+2H2O
2NaOH+H2↑+Cl2↑;AgNO3+2H2O  4Ag+4HNO3+O2↑,各电极上转移的电子的数目相等,根据生成氢气的物质的量计算两个烧杯中生成酸和碱的物质的量,进而计算混合后溶液的PH.
4Ag+4HNO3+O2↑,各电极上转移的电子的数目相等,根据生成氢气的物质的量计算两个烧杯中生成酸和碱的物质的量,进而计算混合后溶液的PH.解:两个烧杯中发生的反应分别为:
2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;4AgNO3+2H2O
 4Ag+4HNO3+O2↑,
4Ag+4HNO3+O2↑,生成氯气的物质的量为:
n(Cl2)=
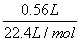 =0.025mol,
=0.025mol,2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑2 1
n(NaOH) 0.025mol
n(NaOH)=0.05mol
两烧杯中含有的n(NaCl)=0.06mol,n(AgNO3)=0.045mol,
以当甲中产生0.56L(标准状况)Cl2时停止电解时,硝酸银完全电解,并进一步电解水,
4AgNO3+2H2O
 4Ag+4HNO3+O2↑
4Ag+4HNO3+O2↑4 4
0.045mol n(HNO3)
n(HNO3)=0.045mol
将两个烧杯混合,碱过量,溶液中过量的OH-离子的物质的量为n(OH-)=0.05mol-0.045mol=0.005mol,
混合后溶液的c(OH-)=
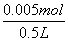 =0.01mol/L,
=0.01mol/L,c(H+)=
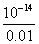 =10-12mol/L,所以PH=12.
=10-12mol/L,所以PH=12.故选D.

练习册系列答案
相关题目
