题目内容
X、Y、Z、W为常见的四种单质,常温下X是固体,Y是液体,Z为无色气体、W是黄绿色气体.它们的反应关系如下,其中B的水溶液有强酸性.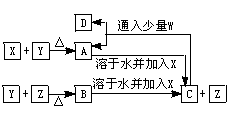
(1)写出X、Y、Z的化学式_______、_______、______.
(2)写出W分子的电子式______,X元素位于周期表_______周期_______族.
(3)写出A溶于水后加入X的离子方程式:_____.
(4)写出C与少量W反应的化学方程式:_____.
(5)写出C与过量W反应的离子方程式:_____.
解析:
| 设计意图:本题是对元素化合物知识的综合考查,侧重考查学生的分析、判断和推理能力,同时考查了学生思维的灵活性与深刻性.
解析:本题比较明显的信息是:W为黄绿色气体,根据中学化学所学知识,可很快推出W为Cl2;而其他物质的推出则需要仔细分析题中所给信息,并从推断范围最小的信息入手. 因X、Y、Z均为单质,且常温下X是固体,Y是液体,Z是无色气体,其中最容易入手的是Y,因常温下呈液态的单质只有溴单质和金属汞,而我们比较熟悉的是溴单质,故可初步推得Y为Br2,由框图信息可知,Y(Br2)和Z(无色气体)能化合生成B,再回想课本上学Br2的性质时,我们最熟悉的就是Br2和H2的反应,且条件也是加热,故此时可初步推得Z为H2,两者反应生成HBr,其水溶液显强酸性,与题中信息相符. 此时再看题中的另一信息: B 根据以上推断,并结合各物质的性质,便不难回答本题问题. 易错点:写Fe的族序数时,错写成ⅧA或ⅧB,这主要是对元素周期表的结构不熟悉而造成;写FeBr2与少量Cl2反应的方程式时,把生成物写成了FeCl3和Br2,这是因为忽略了Cl2的量的问题.FeBr2遇上Cl2时,因Fe2+与Br-都具有还原性,故都有可能被Cl2氧化,但因Fe2+的还原性强于Br-,故当Cl2量不足时,Fe2+优先被氧化;把(3)(5)问中的离子方程式错写成化学反应方程式;不注意方程式的配平. 答案:(1)Fe;Br2;H2 (2)∶ (3)2Fe3++Fe===3Fe2+ (4)6FeBr2+3Cl2===2FeCl3+4FeBr3 (5)2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
|

 快乐5加2金卷系列答案
快乐5加2金卷系列答案(12分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
(1)Z →NO反应的化学方程式是:
液态 Z与水的电离相似,其中存在的电子数相同的两种微粒是 。
(2)实验室中检验Z的化学试剂及现象是:
|
| 化学试剂 | 现象 |
| 方法一 |
|
|
| 方法二 |
|
|
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2:4:3,该离子化合物是 (填写化学式)。
(4) 一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气体中Z与二氧化氮的体积比是 。
(13分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X微粒含有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
(1)Z →NO反应的化学方程式是:
液态 Z的电离与水的电离相似,电离生成电子数相同的两种微粒,写出液态Z的电离方程式 。
(2)实验室中检验Z的化学试剂及现象是:
|
| 化学试剂 | 现象 |
| 方法一 |
|
|
| 方法二 |
|
|
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2︰4︰3,该离子化合物是 (填写化学式),其0.1mol/L的该溶液显酸性,则该溶液中离子浓度由大到小的顺序为 。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气两者的体积比是:
(12分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。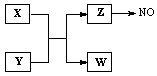
(1)Z →NO反应的化学方程式是:
液态 Z与水的电离相似,其中存在的电子数相同的两种微粒是 。
(2)实验室中检验Z的化学试剂及现象是:
| | 化学试剂 | 现象 |
| 方法一 | | |
| 方法二 | | |
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气体中Z与二氧化氮的体积比是 。
(12分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
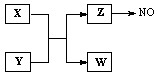
(1)Z →NO反应的化学方程式是:
液态 Z与水的电离相似,其中存在的电子数相同的两种微粒是 。
(2)实验室中检验Z的化学试剂及现象是:
|
|
化学试剂 |
现象 |
|
方法一 |
|
|
|
方法二 |
|
|
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2:4:3,该离子化合物是 (填写化学式)。
(4) 一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气体中Z与二氧化氮的体积比是 。
(13分)X、Y、Z、W为常见含有相同电子数的离子或分子, 其中X微粒含有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
(1)Z →NO反应的化学方程式是:
液态 Z的电离与水的电离相似,电离生成电子数相同的两种微粒,写出液态Z的电离方程式 。
(2)实验室中检验Z的化学试剂及现象是:
|
|
化学试剂 |
现象 |
|
方法一 |
|
|
|
方法二 |
|
|
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2︰4︰3,该离子化合物是 (填写化学式),其0.1 mol/L的该溶液显酸性,则该溶液中离子浓度由大到小的顺序为 。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气两者的体积比是: