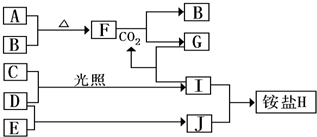
题目内容
为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈黄绿色,说明氯水中含有的粒子是______;
(2)向氯水中,滴入碳酸钠溶液,有气体生成,说明氯水中含有的粒子是______;
(3)在氯水的试管中的有色布条褪色,说明氯水中含有的粒子是______;
(4)写出氯气与水反应的化学方式______;
(5)写出氯气与金属铁反应化学方程式:______.
解:(1)氯气的颜色是黄绿色,故答案为:Cl2;
(2)强酸中的H+能和碳酸钠反应生成二氧化碳,故答案为:H+;
(3)次氯酸有漂白性,故答案为:HClO;
(4)通过以上分析知,溶液中中有HCl、HClO和Cl2,所以溶液中存在一个反应平衡,故答案为:Cl2+H2O?HCl+HClO;
(5)氯气有强氧化性,能把变价金属氧化成最高价,故答案为:2Fe+3 Cl2 2FeCl3
2FeCl3
分析:(1)根据氯气的物理性质判断;
(2)根据强酸和弱酸的关系判断;
(3)根据次氯酸的性质判断;
(4)根据以上分析得出生成物,从而写出反应方程式;
(5)根据氯气的化学性质判断;
点评:本题考查了氯气的化学性质及氯水的成分,侧重考查学生对氯水成分的分析能力.
(2)强酸中的H+能和碳酸钠反应生成二氧化碳,故答案为:H+;
(3)次氯酸有漂白性,故答案为:HClO;
(4)通过以上分析知,溶液中中有HCl、HClO和Cl2,所以溶液中存在一个反应平衡,故答案为:Cl2+H2O?HCl+HClO;
(5)氯气有强氧化性,能把变价金属氧化成最高价,故答案为:2Fe+3 Cl2
 2FeCl3
2FeCl3分析:(1)根据氯气的物理性质判断;
(2)根据强酸和弱酸的关系判断;
(3)根据次氯酸的性质判断;
(4)根据以上分析得出生成物,从而写出反应方程式;
(5)根据氯气的化学性质判断;
点评:本题考查了氯气的化学性质及氯水的成分,侧重考查学生对氯水成分的分析能力.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目