题目内容
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变产生H2的量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 0.1 mol/L的盐酸
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 0.1 mol/L的盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.③⑥⑦⑧ |
C
试题分析:影响反应速率的外界条件一般是温度、浓度、压强等。稀释降低氢离子的浓度,反应速率降低。加入氢氧化钠,消耗氢离子,降低氢离子的浓度,反应速率降低。滴入几滴浓硫酸,增大氢离子浓度,反应速率增大,铁不足,生成的氢气体积不变。加入醋酸钠固体,可以结合氢离子,降低氢离子的浓度,反应速率降低。由于随着反应的进行,氢离子又逐渐电离出来,生成氢气的体积不变。氯化钠溶液相当于是稀释,降低氢离子的浓度,反应速率降低。加入硫酸铜,铁置换出铜,构成原电池,加快反应速率,但消耗了铁,生成的氢气体积减少。升高温度,加快反应速率,且生成的氢气体积不变。改用10 mL 0.1 mol/L的盐酸,增大氢离子的浓度,反应速率增大,生成的氢气体积不变,所以正确的答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点。侧重对学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力。该题的关键是明确外界条件同时如何影响反应速率的,然后具体问题、具体分析即可。

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
 CO(g)+H2(g)在一恒容密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一恒容密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是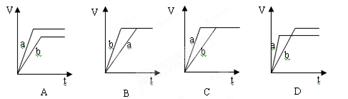
 CH3COOCH2CH3+H2O,下列说法错误的是
CH3COOCH2CH3+H2O,下列说法错误的是 2NH3(g);△H<0。当分离出NH3后下列说法正确的是
2NH3(g);△H<0。当分离出NH3后下列说法正确的是 C(g)在密闭容器中进行,下列情况中,不能使化学反应速率加快的是
C(g)在密闭容器中进行,下列情况中,不能使化学反应速率加快的是