题目内容
【题目】锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质转移到MnO2晶格中生成LiMnO2。请回答下列问题:
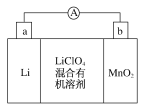
(1)外电路的电流方向是由___极流向___极(填字母)。
(2)负极的电极反应式为___。
(3)是否可用水代替电池中的混合有机溶剂___(填“是”或“否”);原因是___。
【答案】b a Li-e-=Li+ 否 电极Li是活泼金属,能与水反应
【解析】
形成原电池反应时,Li为负极,被氧化,电极方程式为Li-e-=Li+,MnO2为正极,被还原,电极方程式为MnO2+e-+Li+=LiMnO2,结合电极方程式以及元素化合价的变化解答该题。
(1)该电池中Li失去电子生成Li+,所以Li作电池的负极,则a是负极,b是正极,所以外电路中的电流方向由正极流向负极,所以从b流向a。
(2)负极发生氧化反应,即Li失去电子生成Li+,电极反应式为Li-e-=Li+。
(3)不能用水代替电池中的混合有机溶剂,因为Li是活泼金属,与水反应,无法参与原电池反应,不能产生电流。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
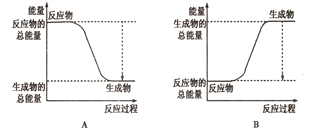
①下图能正确表示该反应中能量变化的是________;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时![]() (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
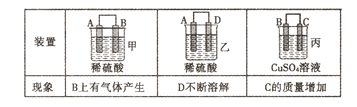
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。