题目内容
(2013?河池模拟)现有44g Mg、Al、Zn、Fe多种活泼金属粉末的混合物与体积为1L质量分数为20%的硫酸溶液恰好完全反应,经处理后得到无水硫酸盐140g,则下列说法正确的是( )
分析:金属与硫酸恰好反应生成硫酸盐与氢气,根据质量守恒可知m(SO42-)=140g-44g=96g,则n(H2SO4)=n(SO42-)=
=1mol,根据关系式H2SO4~H2↑计算氢气的体积;再根据c=
计算硫酸的物质的量浓度;根据m=nM计算m(H2SO4),再结合质量分数计算硫酸溶液的质量.
| 96g |
| 96g/mol |
| n |
| V |
解答:解:金属与硫酸恰好反应生成硫酸盐与氢气,根据质量守恒可知m(SO42-)=140g-44g=96g,则n(H2SO4)=n(SO42-)=
=1mol,
A.根据关系式H2SO4~H2↑可知,n(H2)=n(H2SO4)=1mol,故V(H2)=1mol×22.4L/mol=22.4L,故A正确,
B.硫酸物质的量浓度为
=1mol/L,故B错误;
C.m(H2SO4)=1mol×98g/mol=98g,故硫酸溶液的质量为
=490g,故C错误;
D.由上述分析可知,可以氢气体积、硫酸物质的量浓度、硫酸溶液质量,故D错误,
故选A.
| 96g |
| 96g/mol |
A.根据关系式H2SO4~H2↑可知,n(H2)=n(H2SO4)=1mol,故V(H2)=1mol×22.4L/mol=22.4L,故A正确,
B.硫酸物质的量浓度为
| 1mol |
| 1L |
C.m(H2SO4)=1mol×98g/mol=98g,故硫酸溶液的质量为
| 98g |
| 20% |
D.由上述分析可知,可以氢气体积、硫酸物质的量浓度、硫酸溶液质量,故D错误,
故选A.
点评:本题以化学反应的计算为载体,实质考查学生利用守恒思想计算的计算等,难度中等,计算硫酸根的质量是关键.

练习册系列答案
相关题目
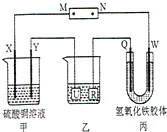 (2013?河池模拟)如图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深.下列说法中错误的是( )
(2013?河池模拟)如图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深.下列说法中错误的是( ) (2013?河池模拟)芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素.
(2013?河池模拟)芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素.


 的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式:
的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式: