МвДҝДЪИЭ
ДҝЗ°БчРРөД№ШУЪЙъГьЖрФҙјЩЙиөДАнВЫИПОӘ,ЙъГьЖрФҙУЪФј40ТЪДкЗ°өД№ЕСуөЧөДИИТә»·ҫіЎЈХвЦЦ»·ҫіПөНіЦРЖХұйҙжФЪМъБтҙШҪб№№,ИзFe2S2ЎўFe4S4ЎўFe8S7өИ,ХвР©МъБтҙШҪб№№ІОУлБЛЙъГьЖрФҙөДПа№Ш·ҙУҰЎЈДі»ҜС§РЛИӨРЎЧйФЪСРҫҝДіМъБтҙШҪб№№өДЧйіЙКұ,ЙијЖБЛПВБРКөСйЎЈ
ЎҫКөСйўсЎҝ БтөДЦКБҝИ·¶Ё:
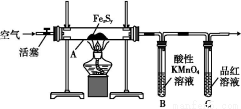
°ҙНјБ¬ҪУЧ°ЦГ,јмІйәГЧ°ЦГөДЖшГЬРФәу,ФЪУІЦКІЈБ§№ЬAЦР·ЕИл1.0 gМъБтҙШҪб№№(ә¬УРІҝ·ЦІ»·ҙУҰөДФУЦК),ФЪКФ№ЬBЦРјУИл50 mL 0.1 molЎӨL-1өДЛбРФKMnO4ИЬТә,ФЪКФ№ЬCЦРјУИлЖ·әмИЬТәЎЈНЁИлҝХЖшІўјУИИ,·ўПЦ№ММеЦрҪҘЧӘұдОӘәмЧШЙ«ЎЈҙэ№ММеНкИ«ЧӘ»ҜәуҪ«BЦРИЬТәЧӘТЖЦБ250 mLИЭБҝЖҝ,ПҙөУКФ№ЬBәу¶ЁИЭЎЈИЎ25.00 mLёГИЬТәУГ0.01 molЎӨL-1 өДІЭЛб(H2C2O4)ҪшРРІв¶ЁКЈУаKMnO4ИЬТәЕЁ¶ИөДөО¶ЁЎЈјЗВјКэҫЭИзПВ:
өО¶ЁҙОКэ | ҙэІвИЬТә Ме»э/mL | ІЭЛбИЬТәМе»э/mL | |
өО¶ЁЗ°ҝМ¶И | өО¶ЁәуҝМ¶И | ||
1 | 25.00 | 1.50 | 23.70 |
2 | 25.00 | 1.02 | 26.03 |
3 | 25.00 | 0.00 | 24.99 |
Па№Ш·ҙУҰ:ўЩ2Mn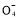 +2H2O+5SO2
+2H2O+5SO2 2Mn2++5S
2Mn2++5S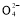 +4H+
+4H+
ўЪ2Mn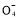 +6H++5H2C2O4
+6H++5H2C2O4 2Mn2++10CO2Ўь+8H2O
2Mn2++10CO2Ўь+8H2O
ЎҫКөСйўтЎҝ МъөДЦКБҝИ·¶Ё:
Ҫ«КөСйўсУІЦКІЈБ§№ЬAЦРөДІРБф№ММејУИлПЎСОЛбЦР,ід·ЦҪБ°иәу№эВЛ,ФЪВЛТәЦРјУИлЧгБҝөДNaOHИЬТә,№эВЛәуИЎВЛФь,ҫӯід·ЦЧЖЙХөГ0.6 g№ММеЎЈ
КФ»ШҙрПВБРОКМв:
(1)јмІйЎ°КөСйўсЎұЦРЧ°ЦГЖшГЬРФөД·Ҫ·ЁКЗ ЎЈ
(2)өО¶ЁЦХөгөДЕР¶П·Ҫ·ЁКЗ ЎЈ
(3)КФ№ЬCЦРЖ·әмИЬТәөДЧчУГКЗ ЎЈ
УРН¬С§Мбіц,і·ИҘCЧ°ЦГ,¶ФКөСйГ»УРУ°Пм,ДгөДҝҙ·ЁКЗЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎ (СЎМоЎ°Н¬ТвЎұ»тЎ°І»Н¬ТвЎұ),АнУЙКЗ ЎЈ
(4)ёщҫЭКөСйўсәНКөСйўтЦРөДКэҫЭҝЙИ·¶ЁёГМъБтҙШҪб№№өД»ҜС§КҪОӘ ЎЈ
ЎҫОКМвМҪҫҝЎҝ өО¶Ё№эіМЦР,ПёРДөДРЎГч·ўПЦёГKMnO4СХЙ«НКИҘөДЛЩВКҪПЖҪіЈөО¶ЁКұТӘҝмөГ¶аЎЈОӘСРҫҝҝмөДФӯТт,јЧН¬С§јМРшҪшРРБЛПВБРКөСй,КөСйКэҫЭИзПВұн:
ұаәЕ | ОВ¶И/Ўж | Лб»ҜөДH2C2O4 ИЬТә/mL | KMnO4 ИЬТә/mL | ИЬТәНК Й«Кұјд/s |
1 | 25 | 5.0 | 2.0 | 40 |
2 | 25 | 5.0(БнјУЙЩБҝҝЙИЬ УЪЛ®өДMnSO4·ЫД©) | 2.0 | 4 |
3 | 60 | 5.0 | 2.0 | 25 |
(5)·ЦОцЙПКцКэҫЭ,өО¶Ё№эіМЦР·ҙУҰЛЩВКҪПҝмөДТ»ЦЦҝЙДЬФӯТтКЗ ЎЈ
(1)ФЪКФ№ЬCЦРјУИлЙЩБҝЛ®,№ШұХ»оИы,УГКЦОжЧЎУІЦКІЈБ§№ЬA(»тУГҫЖҫ«өЖОўИИ),CЦРУРЖшЕЭІъЙъ,ЛЙҝӘКЦ(»ті·ИҘҫЖҫ«өЖ),УРЛ®ҪшИлөјЖш№ЬІўРОіЙТ»¶ОЛ®Цщ,ЦӨГчЖшГЬРФБјәГ
(2)өұөОИлЧоәуТ»өОІЭЛбИЬТәКұ,Ч¶РОЖҝЦРИЬТәЧПәмЙ«БўјҙұдОӘОЮЙ«,ЗТ°л·ЦЦУІ»ұдЙ«
(3)СйЦӨSO2КЗ·сұ»ЛбРФKMnO4ИЬТәНкИ«ОьКХ
Н¬ТвЎЎBЦРИЬТәІ»НКЙ«,јҙҝЙЦӨГчSO2ТСұ»ЛбРФKMnO4ИЬТәНкИ«ОьКХ
(4)Fe3S4
(5)ЙъіЙөДMn2+¶Ф·ҙУҰЖрөҪҙЯ»ҜЧчУГ(»т·ҙУҰ·ЕИИК№ОВ¶ИЙэёЯ,јУҝм·ҙУҰЛЩВК)
ЎҫҪвОцЎҝ(4)өЪ1ҙОH2C2O4ИЬТәМе»эОуІоҪПҙу,ЙбИҘЎЈөЪ2Ўў3ҙОИЎЖҪҫщЦөЎЈV(H2C2O4)=25.00 mLЎЈУлH2C2O4·ҙУҰөДKMnO4өДОпЦКөДБҝОӘ:0.01 molЎӨL-1ЎБ0.025 LЎБ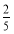 ЎБ10=0.001 mol,УлSO2·ҙУҰөДKMnO4өДОпЦКөДБҝОӘ:0.05 LЎБ0.1 molЎӨL-1-0.001 mol=0.004 mol,n(SO2)=0.004 molЎБ2.5=0.01 mol,n(S)=0.01 molЎБ32 gЎӨmol-1=0.32 g;0.6 g№ММеОӘFe2O3,n(Fe)=
ЎБ10=0.001 mol,УлSO2·ҙУҰөДKMnO4өДОпЦКөДБҝОӘ:0.05 LЎБ0.1 molЎӨL-1-0.001 mol=0.004 mol,n(SO2)=0.004 molЎБ2.5=0.01 mol,n(S)=0.01 molЎБ32 gЎӨmol-1=0.32 g;0.6 g№ММеОӘFe2O3,n(Fe)= ЎБ2 mol=0.007 5 mol,m(Fe)=0.007 5 molЎБ56 gЎӨmol-1=0.42 g;
ЎБ2 mol=0.007 5 mol,m(Fe)=0.007 5 molЎБ56 gЎӨmol-1=0.42 g;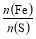 =
=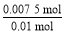 =
=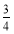 ,ЛщТФёГМъБтҙШҪб№№өД»ҜС§КҪОӘFe3S4ЎЈ(5)1Ўў2¶ФұИ,ФцјУMn2+,·ҙУҰЛЩВКјУҝм;1Ўў3¶ФұИ,ОВ¶ИЙэёЯ,·ҙУҰЛЩВКјУҝмЎЈ
,ЛщТФёГМъБтҙШҪб№№өД»ҜС§КҪОӘFe3S4ЎЈ(5)1Ўў2¶ФұИ,ФцјУMn2+,·ҙУҰЛЩВКјУҝм;1Ўў3¶ФұИ,ОВ¶ИЙэёЯ,·ҙУҰЛЩВКјУҝмЎЈ

 АшФЕКйТөКојЩПОҪУДюІЁіц°жЙзПөБРҙр°ё
АшФЕКйТөКојЩПОҪУДюІЁіц°жЙзПөБРҙр°ёёщҫЭұнЦРРЕПў,ЕР¶ППВБРРрКцЦРХэИ·өДКЗ(ЎЎЎЎ)
РтәЕ | Сх»ҜјБ | »№ФӯјБ | ЖдЛы·ҙУҰОп | Сх»ҜІъОп | »№ФӯІъОп |
ўЩ |
| FeBr2 | / |
| Cl- |
ўЪ | KClO3 | ЕЁСОЛб | / | Cl2 |
|
ўЫ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.ұнЦРўЩЧйөД·ҙУҰҝЙДЬУРТ»ЦЦ»тБҪЦЦФӘЛШұ»Сх»Ҝ
B.Сх»ҜРФЗҝИхөДұИҪП:KClO3>Fe3+>Cl2>Br2
C.ұнЦРўЪЧй·ҙУҰөД»№ФӯІъОпКЗKCl,өзЧУЧӘТЖКэДҝКЗ6NA
D.ұнЦРўЫЧй·ҙУҰөДАлЧУ·ҪіМКҪОӘ:2MnO4ЎӘ+3H2O2+6H+ 2Mn2++4O2Ўь+6H2O
2Mn2++4O2Ўь+6H2O