题目内容
将一定量的Na2CO3和NaHCO3混合物加热到不再放出气体为止,收集到11g CO2,冷却后,向残余物中加入足量盐酸又收集到22g CO2。则原混合物中Na2CO3和NaHCO3的质量比为( )
A.42:53 B.53:42 C.26.5:42 D.42:26.5
【答案】
C
【解析】
试题分析:由2NaHCO3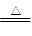 Na2CO3+CO2↑+H2O知:若NaHCO3受热产生11g CO2时则知n(NaHCO3)=0.25mol、生成的n(Na2CO3)= 0.25mol,当0.25mol Na2CO3与足量盐酸反应时就能产生11g CO2,故原混合物中Na2CO3和NaHCO3的物质的量都是0.25mol,其质量比为26.5:42。
Na2CO3+CO2↑+H2O知:若NaHCO3受热产生11g CO2时则知n(NaHCO3)=0.25mol、生成的n(Na2CO3)= 0.25mol,当0.25mol Na2CO3与足量盐酸反应时就能产生11g CO2,故原混合物中Na2CO3和NaHCO3的物质的量都是0.25mol,其质量比为26.5:42。
考点:Na2CO3和NaHCO3的性质
点评:本题是一道简单的计算题。对于化学中计算题的解法必须以化学方程式为基准进行计算,而化学方程式的正确性则是接下来计算的前提保证。因此,在解答时,对化学方程式的书写一定仔细检查,以防配平出现,导致会做却失分。

练习册系列答案
相关题目