题目内容
在溶液中进行某化学反应2A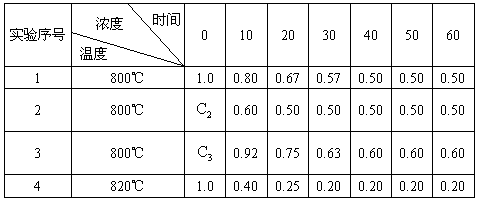
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率(![]() )为________mol/(L·min).
)为________mol/(L·min).
(2)在实验2,A的初始浓度![]() =________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是________.
=________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是________.
(3)设实验3的反应速率为![]() ,实验1的反应速率为
,实验1的反应速率为![]() ,则
,则![]() ________
________![]() (填“>”、“=”、“<”
(填“>”、“=”、“<”![]() ,且
,且![]() ________1.0mol/L(填“>”、“=”、“<”
________1.0mol/L(填“>”、“=”、“<”![]()
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热).理由是__________________________________________________________________________.
解析:
| (1)0.013;(2)1.0,使用催化剂;(3)>,>;(4)吸热,温度升高时,平衡向右移动.
|
提示:
| 对于问题(1)只要从化学速率的定义出发,从表中找出反应在10至20分时间内的A浓度变化值,即可求出A的平均速率为 对于问题(2)的解答,首先要从计算800℃该反应的平衡常数(K=1)入手,查出实验2中A的平衡浓度,代入有关平衡表达式即可求出B、C的平衡浓度,进而得出A的初始浓度.比较实验(1)、(2)的条件,温度、浓度相同,达到平衡的时间不相同,从中推测出实验2中还存在着催化剂这一隐含条件. 对于问题(3)的解答,也要以K=1入手,求算出40min后B、C的平衡浓度为0.6mol· 对于问题(4)的解答,亦是根据观察表格中的数据入手,实验1到实验4属温度升高,A的平衡浓度减小,说明平衡向着正反应方向移动,该方向为吸热反应.
|

(10 分)
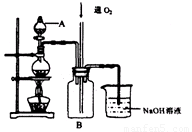
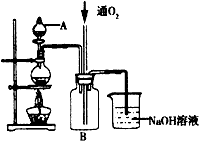
硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加人到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。
(1)图中烧瓶内发生的离子反应方程式为:________________
(2)反应时B瓶内的现象是___________________________
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把 作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节
作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节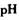 ,产生
,产生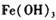 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使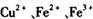 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:
|
物质 |
开始沉淀时的PH |
完全沉淀时的PH |
|
Fe(OH)3 |
1.9 |
3. 2 |
|
Cu(OH)2 |
4. 7 |
6. 7 |
|
Fe(OH)2 |
6. 3 |
9. 7 |
请回答下列问题:
①物质甲 是_____ (填字母序号)。
a.
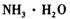 b.
b.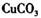 c.
c.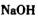 d.
d.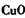
②该方案中调节PH的范围是______ 。

(10 分)
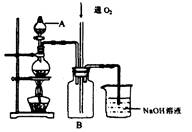
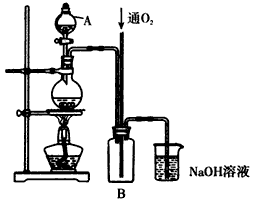
硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加人到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。
(1)图中烧瓶内发生的离子反应方程式为:________________
(2)反应时B瓶内的现象是___________________________
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把![]() 作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节
作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节![]() ,产生
,产生![]() 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使![]() 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:
| 物质 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe(OH)3 | 1.9 | 3. 2 |
| Cu(OH)2 | 4. 7 | 6. 7 |
| Fe(OH)2 | 6. 3 | 9. 7 |
请回答下列问题:
①物质甲 是 (填字母序号)。
a. ![]() b.
b.![]() c.
c.![]() d.
d.![]()
②该方案中调节PH的范围是 。