��Ŀ����
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壬�ϳɰ������������������ˮú������õ����漰��Ӧ��Ϣ���£�
��Ӧ�٣�C��s��+H2O��g��
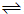
H2��g��+CO��g�� �� ƽ�ⳣ��K1
��Ӧ�ڣ�ƽ�ⳣ�� K2=
��1��K1�ı���ʽ��K1=______����Ӧ�ڵĻ�ѧ����ʽΪ______��
��2���ں���ʱ���Է�Ӧ�٣������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����______������ţ���
A��������ѹǿ���� �� B�����������COŨ�Ȳ���
C���ԣ�H2����=�ԣ�H2O���� D��c��H2O��=c��CO��
��3����һ������H2O��g����CO��g���ֱ�ͨ�뵽���Ϊ1L���ܱ������У��ڲ�ͬ�����½��з�Ӧ���õ������������ݣ�
����ʵ��1�У���CO2��ʾ��Ӧ��ʼ��ƽ���ƽ����Ӧ����Ϊ______��
������ʵ��3����a=0.5��b=1ʱ��Ҫʹc��d������ʵ��2��ͬ����t��3�����Բ�ȡ�Ĵ�ʩΪ______������ţ�
A���������������¶�T��900��B���������������¶�T��900��
C������һ�������� D��ʹ�ø�Ч����
�����ڷ�Ӧ�ڣ��������¶�ʱK2______�����������С�����䡱����
��Ӧ�٣�C��s��+H2O��g��
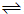
H2��g��+CO��g�� �� ƽ�ⳣ��K1
��Ӧ�ڣ�ƽ�ⳣ�� K2=
| [H2]?[CO2] |
| [CO]?[H2O] |
��1��K1�ı���ʽ��K1=______����Ӧ�ڵĻ�ѧ����ʽΪ______��
��2���ں���ʱ���Է�Ӧ�٣������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����______������ţ���
A��������ѹǿ���� �� B�����������COŨ�Ȳ���
C���ԣ�H2����=�ԣ�H2O���� D��c��H2O��=c��CO��
��3����һ������H2O��g����CO��g���ֱ�ͨ�뵽���Ϊ1L���ܱ������У��ڲ�ͬ�����½��з�Ӧ���õ������������ݣ�
| ʵ����� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
������ʵ��3����a=0.5��b=1ʱ��Ҫʹc��d������ʵ��2��ͬ����t��3�����Բ�ȡ�Ĵ�ʩΪ______������ţ�
A���������������¶�T��900��B���������������¶�T��900��
C������һ�������� D��ʹ�ø�Ч����
�����ڷ�Ӧ�ڣ��������¶�ʱK2______�����������С�����䡱����
��1����ƽ�ⳣ��Ϊ�������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ������K1�ı���ʽ
����Ӧ�ڵĻ�ѧ����ʽΪ CO+H2O

H2+CO2���ʴ�Ϊ��
��CO+H2O

H2+CO2��
��2��A���������巴Ӧǰ��Ļ�ѧ���������ȣ�����������ѹǿ��������Ϊ�жϵ����ݣ���A��ȷ��
B�����ﵽ��ѧƽ��ʱ�����������c��CO�����䣬��B��ȷ��
C��V����H2��=V�棨H2O����˵���ﵽƽ��״̬����C��ȷ��
D��c��CO2����c��CO���Ĵ�С��ϵȡ���ڷ�Ӧ��ʼʱ�����ʵ����Ķ��٣�������Ϊ�ж��Ƿ�ﵽƽ������ݣ���D����
�ʴ�Ϊ��D��
��3������v��CO2��=
=0.16mol/��L?min�����ʴ�Ϊ��0.16��
����ʵ��3Ҫ�ﵽ��ʵ��2��Ч��ƽ��״̬��������ƽ���ʱ��̣��ʲ�ȡ�Ĵ�ʩҪʹ�÷�Ӧ���ʿ죬��ƽ�ⲻ�ƶ����ʴ�Ϊ��D��
������ʵ��1��2�����õ�Чƽ���жϸ÷�ӦΪ���ȣ������¶ȣ�ƽ�������ȵķ����ƶ��������ƶ�������ƽ�ⳣ����С����ѡ����С��
| C(H2)C(CO) |
| C(H2O) |

H2+CO2���ʴ�Ϊ��
| C(H2)C(CO) |
| C(H2O) |

H2+CO2��
��2��A���������巴Ӧǰ��Ļ�ѧ���������ȣ�����������ѹǿ��������Ϊ�жϵ����ݣ���A��ȷ��
B�����ﵽ��ѧƽ��ʱ�����������c��CO�����䣬��B��ȷ��
C��V����H2��=V�棨H2O����˵���ﵽƽ��״̬����C��ȷ��
D��c��CO2����c��CO���Ĵ�С��ϵȡ���ڷ�Ӧ��ʼʱ�����ʵ����Ķ��٣�������Ϊ�ж��Ƿ�ﵽƽ������ݣ���D����
�ʴ�Ϊ��D��
��3������v��CO2��=
| 0.8mol/L |
| 5min |
����ʵ��3Ҫ�ﵽ��ʵ��2��Ч��ƽ��״̬��������ƽ���ʱ��̣��ʲ�ȡ�Ĵ�ʩҪʹ�÷�Ӧ���ʿ죬��ƽ�ⲻ�ƶ����ʴ�Ϊ��D��
������ʵ��1��2�����õ�Чƽ���жϸ÷�ӦΪ���ȣ������¶ȣ�ƽ�������ȵķ����ƶ��������ƶ�������ƽ�ⳣ����С����ѡ����С��

��ϰ��ϵ�д�
�����Ŀ
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��  2NH3��g��������ӦΪ���ȷ�Ӧ����673K��30MPa�£�n��NH3����n��H2����ʱ�� t�仯�Ĺ�ϵ��ͼ��ʾ�����������У���ȷ���ǣ�������
2NH3��g��������ӦΪ���ȷ�Ӧ����673K��30MPa�£�n��NH3����n��H2����ʱ�� t�仯�Ĺ�ϵ��ͼ��ʾ�����������У���ȷ���ǣ�������
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��