题目内容
16.浓度均为0.1mol•L-1的CH3COOH、HCl、H2SO4溶液各100mL;(1)分别与经砂纸打磨过的表面积相同的足量镁条反应,化学反应速率按由快到慢的顺序排列为H2SO4>HCl>CH3COOH(用化学式表示,下同),生成H2的体积(相同条件下)的大小关系为H2SO4>HCl=CH3COOH
(2)分别与等浓度的NaOH溶液反应,消耗NaOH溶液体积的大小关系为H2SO4>HCl=CH3COOH.
分析 (1)Mg和相同浓度的CH3COOH、HCl、H2SO4溶液反应,反应速率与氢离子浓度成正比,氢离子浓度越大反应速率越快;生成氢气体积与最终电离出n(H+)成正比;
(2)分别与等浓度的NaOH溶液反应,消耗NaOH溶液体积与最终电离n(H+)成正比.
解答 解:(1)Mg和相同浓度的CH3COOH、HCl、H2SO4溶液反应,反应速率与氢离子浓度成正比,氢离子浓度越大反应速率越快,0.1mol/L的CH3COOH、HCl、H2SO4溶液中,HCl和是H2SO4强电解质,完全电离,CH3COOH是弱电解质,部分电离,所以这三种酸中氢离子浓度大小顺序是H2SO4>HCl>CH3COOH,则反应速率大小顺序是H2SO4>HCl>CH3COOH;
生成氢气体积与最终电离出n(H+)成正比,CH3COOH、HCl是一元酸而硫酸是二元酸,相同浓度相同体积的CH3COOH、HCl、H2SO4溶液,最终电离出n(H+)大小顺序是H2SO4>HCl=CH3COOH,所以生成氢气体积大小顺序是H2SO4>HCl=CH3COOH,
故答案为:H2SO4>HCl>CH3COOH;H2SO4>HCl=CH3COOH;
(2)分别与等浓度的NaOH溶液反应,消耗NaOH溶液体积与最终电离n(H+)成正比,CH3COOH、HCl是一元酸而硫酸是二元酸,相同浓度相同体积的CH3COOH、HCl、H2SO4溶液,最终电离出n(H+)大小顺序是H2SO4>HCl=CH3COOH,则消耗NaOH体积大小顺序是H2SO4>HCl=CH3COOH,故答案为:H2SO4>HCl=CH3COOH.
点评 本题考查弱电解质的电离,为高频考点,化学反应速率与离子浓度成正比、酸中和碱或酸与金属反应生成氢气体积都与最终电离出n(H+)成正比,与酸的强弱无关,为易错题.

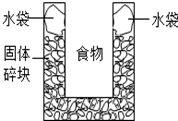 如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )
如图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度明显上升.制造此加热杯可选用的固体碎块是( )| A. | 硝酸铵 | B. | 食盐 | C. | 蔗糖 | D. | 生石灰 |
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 18种 |
| A. | Na2CO3溶液c(Na+)与c(CO32-)之比为2:1 | |
| B. | pH=2和pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1 | |
| D. | pH=1的硫酸中加入等体积0.1 mol/L的BaCl2溶液,两者恰好反应 |
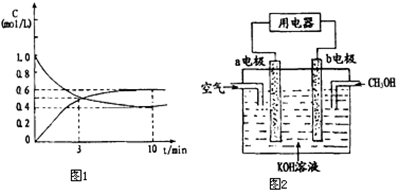
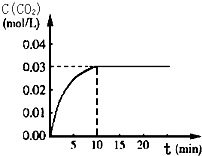 K增大的有A(填字母)
K增大的有A(填字母)