题目内容
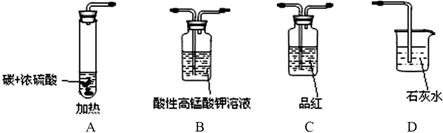
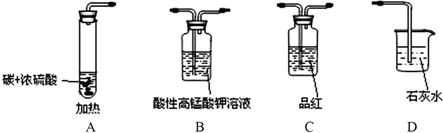
某同学用下图仪器进行实验并检查反应的气态产物CO2与SO2(图中加热及夹持仪器略去).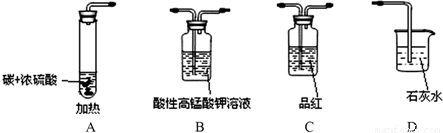
(1)碳与浓硫酸化学反应方程式为______ CO2↑+2SO2↑+2H2O;
【答案】分析:(1)碳与浓硫酸加热反应生成了二氧化碳、二氧化硫和水;
(2)根据实验目的和气体的性质连接实验装置;
(3)根据实验目的和气体的性质分析;
(4)证明生成气体中含有CO2的现象是E中澄清石灰水变浑浊,但防止二氧化硫气体的干扰;
解答:解:(1)碳与浓硫酸加热反应生成了二氧化碳、二氧化硫和水;C+2H2SO4(浓)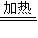 CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(2)验证CO2与SO2,要达到预期的实验目的,先要验证通过品红溶液验证二氧化硫,接着通过高锰酸钾溶液除去二氧化硫,然后通过品红检验二氧化硫是否除尽,最后通过澄清的石灰水检验二氧化碳,这样做能避免造成不必要的干扰,
故答案为:C B C D;
(3)高锰酸钾溶液的作用是除去二氧化硫,故答案为:除去CO2气体中的SO2;
(4)证明生成气体中含有CO2的现象是装置D中 的品红不退色,证明二氧化硫除净,E中石灰水变浑浊证明生成二氧化碳气体;
故答案为:第二次品红溶液不褪色,D中石灰水变浑浊;CO2+Ca2++2OH-═CaCO3↓+H2O;
点评:本题考查碳和浓硫酸反应的原理以及产物的检验,掌握物质性质和检验的顺序是解题关键,题目难度中等.
(2)根据实验目的和气体的性质连接实验装置;
(3)根据实验目的和气体的性质分析;
(4)证明生成气体中含有CO2的现象是E中澄清石灰水变浑浊,但防止二氧化硫气体的干扰;
解答:解:(1)碳与浓硫酸加热反应生成了二氧化碳、二氧化硫和水;C+2H2SO4(浓)
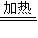 CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;(2)验证CO2与SO2,要达到预期的实验目的,先要验证通过品红溶液验证二氧化硫,接着通过高锰酸钾溶液除去二氧化硫,然后通过品红检验二氧化硫是否除尽,最后通过澄清的石灰水检验二氧化碳,这样做能避免造成不必要的干扰,
故答案为:C B C D;
(3)高锰酸钾溶液的作用是除去二氧化硫,故答案为:除去CO2气体中的SO2;
(4)证明生成气体中含有CO2的现象是装置D中 的品红不退色,证明二氧化硫除净,E中石灰水变浑浊证明生成二氧化碳气体;
故答案为:第二次品红溶液不褪色,D中石灰水变浑浊;CO2+Ca2++2OH-═CaCO3↓+H2O;
点评:本题考查碳和浓硫酸反应的原理以及产物的检验,掌握物质性质和检验的顺序是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。