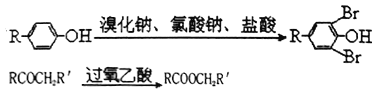
题目内容
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11,Ksp[Fe(OH)3]=8.0×10﹣38,Kb(NH3·H2O)=1.8×10﹣5,下列叙述中不正确的是( )
A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀
B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂
C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强
D.25℃时,NH4++H2O![]() NH3·H2O+H+的平衡常数为5.6×10﹣10
NH3·H2O+H+的平衡常数为5.6×10﹣10
【答案】C
【解析】
试题分析:A、25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,依据溶度积计算生成沉淀时需要的氢氧根离子浓度,形成氢氧化铁所需要的氢氧根离子浓度小,先出现红褐色沉淀,正确;B、25℃时,MgCl2溶液中有少量FeCl3时,存在平衡:Fe3+ + 3H2O![]() Fe(OH)3 + 3H+,加入MgO,氧化镁消耗氯化铁水解生成的氢离子,促进氯化铁水解生成氢氧化铁,同时氧化镁转化成氯化镁,不引入新的杂质,正确;C、25℃时,加大量水稀释氨水,电离程度增大,溶液中自由移动离子的数目增多,但溶液的体积增大为主,溶液中自由移动离子的浓度减小,溶液导电能力减弱,错误;D、25℃时,NH4++H2O
Fe(OH)3 + 3H+,加入MgO,氧化镁消耗氯化铁水解生成的氢离子,促进氯化铁水解生成氢氧化铁,同时氧化镁转化成氯化镁,不引入新的杂质,正确;C、25℃时,加大量水稀释氨水,电离程度增大,溶液中自由移动离子的数目增多,但溶液的体积增大为主,溶液中自由移动离子的浓度减小,溶液导电能力减弱,错误;D、25℃时,NH4++H2O![]() NH3·H2O+H+的平衡常数为Kw/ Kb(NH3·H2O)=(1.0×10-14)/(1.8×10﹣5)=5.6×10﹣10,正确。
NH3·H2O+H+的平衡常数为Kw/ Kb(NH3·H2O)=(1.0×10-14)/(1.8×10﹣5)=5.6×10﹣10,正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目