题目内容
12.下列化学式书写错误的是( )| A. | MgO2 | B. | P2O5 | C. | Fe3O4 | D. | K2MnO4 |
分析 化合物化学式的书写一般规律:金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零,据此进行判断.
解答 解:A.氧化镁中镁元素显+2价,氧元素显-2价,其化学式为MgO,故A错误;
B.五氧化二磷中P的化合价为+5价,其分子式为P2O5,故B正确;
C.四氧化三铁中Fe的化合价为+$\frac{8}{3}$,其化学式为:Fe3O4,故C正确;
D.高锰酸钾中锰元素的化合价为+6价,其化学式为K2MnO4,故D正确;
故选A.
点评 本题考查了常见物质的名称、化学式的书写及判断,题目难度不大,明确常见物质的名称、组成及化学式为解答关键,试题侧重基础知识的考查,培养了学生的规范答题能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已氧化变质 |
| C | 向饱和碳酸钠溶液中通入CO2 | 有晶体析出 | 溶解度:NaHCO3>Na2CO3 |
| D | 向盛有少量NaHCO3的试管中滴加草酸溶液 | 有气泡产生 | 酸性:草酸>碳酸 |
| A. | A | B. | B | C. | C | D. | D |
3.室温下,将 0.1mol下列物质置于1L 水中充分搅拌后,溶液中阴离子数最多的是( )
| A. | KC1 | B. | MgCl2 | C. | Na2CO3 | D. | K2SO4 |
20.下列实验操作中正确的是( )
| A. | 分液时,先从分液漏斗下口放出下层液体,更换烧杯后再从下口放出上层液体 | |
| B. | 蒸馏时,温度计水银球需靠近蒸馏烧瓶支管口,冷凝水的流向需从冷凝管的上进水口流入,下进水口流出 | |
| C. | 分离硝酸钾与氯化钾时,冷却结晶时析出的是溶解度随温度变化较大的固体 | |
| D. | 用托盘天平称量10.2 g固体时,如果砝码误放于左盘,固体放在右盘,则实际称得的固体质量大于10.2 g |
2. 常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.
常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.
请回答下列问题:
(1)写出F的电子式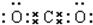 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(2)写出反应Ⅰ的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应中的氧化剂是H2O.
(3)反应Ⅰ、Ⅱ均有清洁能源H2产生,已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态谁放出44kJ的热量.其它相关数据如表:
则表中x为436.
 常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.
常见金属单质A可发生如图所示转化(部分反应物,产物和反应条件已略去).F是一种温室气体;气体G的水溶液显碱性;H是一种具有磁性的黑色氧化物;B,C,D,E四种化合物中含有一种相同的元素.请回答下列问题:
(1)写出F的电子式
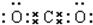 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.(2)写出反应Ⅰ的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应中的氧化剂是H2O.
(3)反应Ⅰ、Ⅱ均有清洁能源H2产生,已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态谁放出44kJ的热量.其它相关数据如表:
| 化学键 | O=O(g) | H-H(g) | H-O(g) |
| 键能/kJ•mol-1 | 496 | x | 463 |