题目内容
14.下列表达方式错误的是( )| A. | D2O分子中氧原子为sp3杂化 | |
| B. | Cr原子价电子排布式:3d54s1 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | S原子的电子排布图: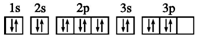 |
分析 A.根据D2O分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4判断;
B.根据全空,全满,半满时能量最低判断;
C.硫原子原子序数为16,则硫离子核外有18个电子;
D.洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同.
解答 解:A.D2O分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4且含有两个孤电子对,为V形结构,中心O原子采用sp3杂化,故A正确;
B.全空,全满,半满时能量最低,所以Cr原子的价电子排布式为3d54s1,故B正确;
C.硫原子原子序数为16,则硫离子核外有18个电子,所以硫离子的核外电子排布式:1s22s22p63s23p6,故C正确;
D.3p轨道上电子首先应尽可能分占不同的轨道,且自旋方向相同,故D错误.
故选D.
点评 本题考查杂化类型的判断、原子核外电子的能级分布,难度不大,注意全空,全满,半满时能量最低.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.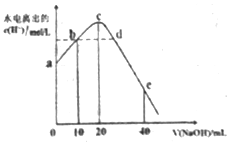 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | a、d对应的纵坐标数值分别是:>10-12、>10-7 |
5.根据下列实验事实,不能得到相应结论的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14 | 常温下,醋酸和氨水的电离平衡常数相等 |
| B | 向均盛有2mL5% H2O2 溶液的两支试管中分别滴入0.2mol•L-1 FeCl3,和0.3mol.L-1CuCl2 溶lmL,前者生成气泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应刚开始时,醋酸电离平衡正移,c(H+)增大 |
| D | 向硼酸(H3BO3)溶液中滴加少量Na2CO3溶液,观察到无明显现象. | H3BO3的酸性弱于H2CO3 |
| A. | A | B. | B | C. | C | D. | D |
2.物质不需要通过化学变化就能体现的性质是( )
| A. | 可燃性 | B. | 不稳定性 | C. | 挥发性 | D. | 氧化性 |
9.对下列实验的现象和结论的分析正确的是( )
| A. | 某溶液$\stackrel{+石蕊}{→}$溶液呈红色:原溶液是酸溶液 | |
| B. | 某溶液$\stackrel{+盐酸酸化}{→}$无明显现象$\stackrel{+BaCl_{2}溶液}{→}$有白色沉淀:原溶液中含SO42- | |
| C. | 某溶液$\stackrel{+酚酞}{→}$溶液呈红色:原溶液是碱溶液 | |
| D. | 某溶液$\stackrel{+稀硫酸}{→}$生成无色无味气体,说明原溶液中有CO32- |
6.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 盐酸 | B. | 雾 | C. | 氯化钠溶液 | D. | CuSO4溶液 |
3.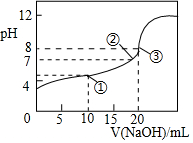 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )| A. | ①点时:c(ClO2-)>c(Na+)>c(H+)>c(OH-) | |
| B. | ②点时:c(Na+)=c(ClO2-) | |
| C. | ③点时:c(H+)=c(OH-)+c(HClO2) | |
| D. | 滴定过程中可能出现:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
15.用NA表示阿伏加德罗常数,下列说法错误的是( )
| A. | 25℃时1mL水中含10-10 NA个OH-离子 | |
| B. | 1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA | |
| C. | a g某气体含分子数为b,c g该气体在标况下的体积约为22.4bc/(aNA)L | |
| D. | 0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA |
