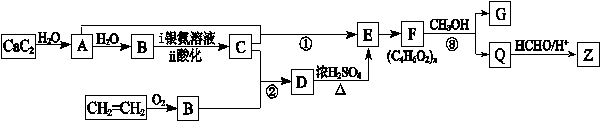
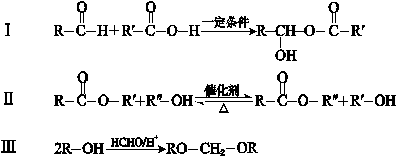
题目内容
在4L恒容密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol?L-1,下列判断正确的是( )
| A.x=3 |
| B.A的转化率为50% |
| C.平衡时3v正(A)=2v逆(C) |
| D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的95% |
A、△n(D)=0.5mol/L×4L=2mol,平衡时生成2molC,故2:x=2mol:2mol,解得x=1,故A错误;
B、平衡时生成2molC,由方程式可知,参加反应的A的物质的量为2mol×
=3mol,故A的转化率为
×100%=50%,gu B正确;
C、可逆反应到达平衡时,不同物质表示的速率之比等于化学计量数之比,即2v正(A)=3v逆(C),故C错误;
D、该反应前后气体的物质的量不变,则压强不变,故D错误;
故选B.
B、平衡时生成2molC,由方程式可知,参加反应的A的物质的量为2mol×
| 3 |
| 2 |
| 3mol |
| 6mol |
C、可逆反应到达平衡时,不同物质表示的速率之比等于化学计量数之比,即2v正(A)=3v逆(C),故C错误;
D、该反应前后气体的物质的量不变,则压强不变,故D错误;
故选B.

练习册系列答案
相关题目
 2Z(g)
2Z(g)