题目内容
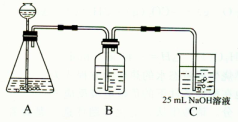
(5分)Na2CO3、NaHCO3、NaCl的固体混合物共4.0 g,把它们加强热到质量不再减轻,冷却后称重为3.38 g。在残余固体中加入过量的盐酸,产生CO20.88 g。回答
(1)原混合物中NaHCO3的质量是多少克?(2)原混合物中含NaCl多少克?
(1)原混合物中NaHCO3的质量是多少克?(2)原混合物中含NaCl多少克?
(5分)(1)1.68 g (2)1.26g
试题分析:(1)碳酸氢钠分解的化学方程式是
2NaHCO3
 Na2CO3+H2O+CO2↑ △m↓
Na2CO3+H2O+CO2↑ △m↓168g 106g 62g
x y 4.0g-3.38g=0.62g
所以x=1.68g、y=1.06g
(2)碳酸钠和盐酸反应的化学方程式是
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106g 44g
2.12g 88g
其中由碳酸氢钠分解生成的碳酸钠是1.06g
所以原混合物中碳酸钠的质量是2.12g-1.06g=1.06g
因此氯化钠的质量是4.0g-1.68g-1.06g=1.26g
点评:该题是中等难度的试题,试题基础性强,难易适中。该题的解题思路是借助于差量法,因此关键是准确写出反应的化学方程式,找出关系式,列式计算即可。该题有利于培养学生的逻辑思维能力和规范答题能力。

练习册系列答案
相关题目