题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 等物质的量的NaN3和Na2O2中所含阴离子数均为NA
B. 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA
C. 标准状况下,将3.36LCl2通入1L0.2mol/LFeBr2溶液中,被氧化的Br-数目为0.1NA
D. 标准状况下,11g由3H和16O组成的超重水中,中子数和电子数之和为10NA
【答案】C
【解析】A项,NaN3中阴离子为N3-,Na2O2中阴离子为O22-,等物质的量的NaN3和Na2O2中阴离子数相等,但由于物质的量未知,所以无法确定阴离子数,错误;B项,若阳极减少的质量全为Cu的质量,电路中转移电子为![]() 2=0.2mol,而电解精炼铜时,阳极应是比Cu活泼的杂质金属优先失电子被氧化,然后Cu失电子被氧化,由于杂质金属的成分和含量未知,所以无法计算电路中转移的电子数,错误;C项,n(Cl2)=
2=0.2mol,而电解精炼铜时,阳极应是比Cu活泼的杂质金属优先失电子被氧化,然后Cu失电子被氧化,由于杂质金属的成分和含量未知,所以无法计算电路中转移的电子数,错误;C项,n(Cl2)=![]() =0.15mol,n(FeBr2)=0.2mol/L
=0.15mol,n(FeBr2)=0.2mol/L![]() 1L=0.2mol,由于还原性:Fe2+
1L=0.2mol,由于还原性:Fe2+![]() Br-,所以Cl2先与Fe2+反应,根据反应Cl2+2Fe2+=2Fe3++2Cl-,0.2molFe2+消耗0.1molCl2,与Fe2+反应后还有0.05molCl2,0.05molCl2和0.4molBr-反应,Br-过量,0.05molCl2能氧化0.1molBr-,被氧化的Br-数为0.1NA,正确;D项,由3H和16O组成的超重水的摩尔质量为22g/mol,11g超重水的物质的量为
Br-,所以Cl2先与Fe2+反应,根据反应Cl2+2Fe2+=2Fe3++2Cl-,0.2molFe2+消耗0.1molCl2,与Fe2+反应后还有0.05molCl2,0.05molCl2和0.4molBr-反应,Br-过量,0.05molCl2能氧化0.1molBr-,被氧化的Br-数为0.1NA,正确;D项,由3H和16O组成的超重水的摩尔质量为22g/mol,11g超重水的物质的量为![]() =0.5mol,1个超重水中含12个中子、10个电子,则11g超重水中含6mol中子、5mol电子,中子数和电子数之和为11NA,错误;答案选C。
=0.5mol,1个超重水中含12个中子、10个电子,则11g超重水中含6mol中子、5mol电子,中子数和电子数之和为11NA,错误;答案选C。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】某兴趣小组运用下图所示组合装置(部分夹持装置未画出)进行探究实验
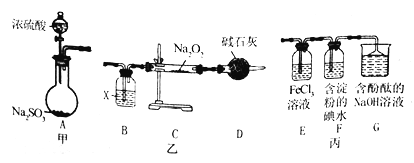
请回答下列问题:
(1)A同学将甲、乙装置组合进行进行实验,其实验目的是探究______反应的生成物;在连接好装置后,首先要进行的实验操作为____________。
(2)为检验C装置中反应生成物是否有氧气,装置B中盛放的试剂X应为______,装置D中碱石灰的作用是 _______;实验操作及现象是______。
(3)b同学将甲、丙装置组合进行实验,能说明I-的还原性弱于 SO2的现象为_____,发生反应的离子方程式是________。
(4)装置G中的现象是________,说明SO2具有____________性。
(5)为验证装置中SO2与FeCl3发生了氧化还原反应,C同学设计了两套方案,完成下表:
实验操作 | 实验现象 | 实验结论 | |
方案1 | 取少量装置E中的溶液于试管中,向其中滴加____溶液 | 产生白色沉淀 | SO2与FeCl3发生氧化还原反应 |
方案2 | 取少量装置E中的溶液于试管中,向其中滴加 ____溶液 | ____________ |