题目内容
4.A、B、C、D是中学化学中常见物质,常温下发生如下反应A+B═C+D+H2O(各物质系数未定,下同)(1)若A是非金属单质,B是碱,写出符合该反应的离子方程式:Cl2+2OH-═Cl-+ClO-+H2O
(2)若A是黑色氧化物,CD皆为盐,该反应为非氧化还原反应.写出符合该反应的离子方程式:Fe3O4+8H+═Fe2++2Fe3++4H2O
(3)若A是不同于(2)中的黑色氧化物,B是稀溶液,C是对大气有污染的气体,写出 符合该反应的化学方程式:3FeO+10HNO3(稀)═3Fe(NO3)3+NO↑+5H2O
(4)常温下发生如下反应C+D+H2O═A+B
①若C是金属单质,写出符合该反应的离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑
②若C是非金属单质,写出符合该反应的离子方程式:Si+H2O+2OH-═SiO32-+2H2↑.
分析 (1)若A是非金属单质,B是碱,A可以为氯气,B可以为氢氧化钠;
(2)若A是黑色氧化物,C、D皆为盐,该反应为非氧化还原反应,A可以为四氧化三铁,B可以为盐酸;
(3)若A是不同于(2)中的黑色氧化物,B是稀溶液,C是对大气有污染的气体,A为FeO,B为稀硝酸,C为一氧化氮气体;
(4)常温下发生如下反应C+D+H2O═A+B,①若C是金属单质,C为金属铝,D为NaOH;
②若C是非金属单质,C为Si,D为氢氧化钠,据此书写离子方程式.
解答 解:(1)联系卤素单质与碱溶液的反应可知,C可以为氯气,该反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)若A是黑色氧化物,C、D皆为盐,该反应为非氧化还原反应,联系四氧化三铁的性质可知,A可以为四氧化三铁,B可以为盐酸,该反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O,
故答案为:Fe3O4+8H+═Fe2++2Fe3++4H2O;
(3)若A是不同于(2)中的黑色氧化物,B是稀溶液,C是对大气有污染的气体,该气体可能为NO,则A可以为FeO,B为稀硝酸,该反应的化学方程式为:3FeO+10HNO3(稀)═3Fe(NO3)3+NO↑+5H2O,
故答案为:3FeO+10HNO3(稀)═3Fe(NO3)3+NO↑+5H2O;
(4)常温下发生如下反应C+D+H2O═A+B,
①若C是金属单质,C可以为铝,D为NaOH,该反应的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
②若C是非金属单质,C可以为Si、D为NaOH,该反应的离子方程式为:Si+H2O+2OH-═SiO32-+2H2↑,
故答案为:Si+H2O+2OH-═SiO32-+2H2↑.
点评 本题考查无机物的推断,题目难度中等,明确常见元素及其化合物性质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及逻辑推理能力.

| A. | 晶体硅 | B. | 食盐 | C. | 干冰 | D. | 金属钾 |
①HCl比H2S稳定
②HCl和H2S的水溶液前者的酸性强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A. | ②⑤ | B. | ①② | C. | ①②⑤ | D. | ①③⑤ |
 某同学设计如图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+═Cr2O72-+H2O).下列说法正确的是( )
某同学设计如图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+═Cr2O72-+H2O).下列说法正确的是( )| A. | A为正极,B为负极 | |
| B. | 电解过程中,电解槽左侧溶液pH增大 | |
| C. | 电解过程中,Na+在电解槽中自左向右迁移 | |
| D. | 当电路中通过lmol电子时,阴极生成0.5mol Na2Cr2O7 |
| A. | 若反应X+Y=M是放热反应,该反应一定不用加热 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| D. | 酸与碱的中和反应是吸热的 |
| A. | 都易溶于水 | B. | 苯易与液溴发生加成反应 | ||
| C. | 乙酸溶液显酸性 | D. | 乙醇不能与金属钠反应 |


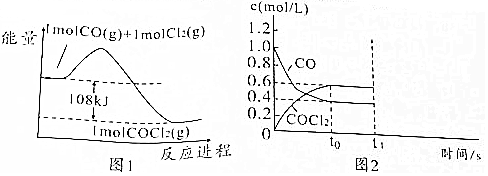
 ;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;
;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;