题目内容
8.X、Y、Z、W是中学化学中常见的四种气体.已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,呈现红棕色,并能与水反应;W气体的水溶液滴入酚酞变红色.请回答下列问题:
(1)写出各物质的化学式XSO2,YCl2,ZNO2,WNH3;
(2)X、Y两种气体按物质的量之比1:1的比例通入品红溶液中,品红不褪色,原因(用化学方程式表示)Cl2+SO2+2H2O═2HCl+H2SO4;
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为1:2.
(4)W和Z在催化剂的作用下可以转化成两种无污染的物质,反应方程式:6NO2+8NH3$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O.
分析 X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收,说明这三种气体能和碱反应,X是化石燃料燃烧的产物之一,是形成酸雨的主要物质,化石中含有S元素,二氧化硫和氮氧化物是酸性酸雨的主要气体,所以X是SO2;Y是一种单质,它的水溶液具有漂白作用,氯气和水反应生成的次氯酸具有漂白性,所以Y是Cl2;Z是硝酸工业和汽车尾气中的有害物质之一,呈现红棕色,并能与水反应,则Z是NO2,W气体的水溶液滴入酚酞变红色,则W为氨气,结合物质的性质分析解答.
解答 解:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收,说明这三种气体能和碱反应,X是化石燃料燃烧的产物之一,是形成酸雨的主要物质,化石中含有S元素,二氧化硫和氮氧化物是酸性酸雨的主要气体,所以X是SO2;Y是一种单质,它的水溶液具有漂白作用,氯气和水反应生成的次氯酸具有漂白性,所以Y是Cl2;Z是硝酸工业和汽车尾气中的有害物质之一,呈现红棕色,并能与水反应,则Z是NO2,W气体的水溶液滴入酚酞变红色,则W为NH3,
(1)根据上面的分析可知,X是SO2,Y是Cl2,Z是NO2,W为NH3,
故答案为:SO2;Cl2;NO2;NH3;
(2)SO2、Cl2两种气体按物质的量之比1:1的比例通入品红溶液中,因为它们能发生氧化还原反应生成硫酸和盐酸,所以品红不褪色,反应的化学方程式为Cl2+SO2+2H2O═2HCl+H2SO4,
故答案为:不褪色;Cl2+SO2+2H2O═2HCl+H2SO4;
(3)Z与水的反应的方程式为3NO2+H2O═NO+2HNO3,根据方程式可知,氧化剂与还原剂的物质的量之比为1:2,
故答案为:1:2;
(4)NO2和NH3在催化剂的作用下可以转化成两种无污染的物质,根据元素守恒可知产物应为水和氮气,反应方程式为6NO2+8NH3$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O,
故答案为:6NO2+8NH3$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O.
点评 本题考查了无机物的推断,根据物质化学性质等来分析解答,知道形成酸雨的气体,难度不大.

| A. | 质量 | B. | 分子数 | C. | 密度 | D. | 原子数 |
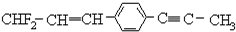 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 12个碳原子不可能都在同一平面上 | |
| B. | 处于同一直线上的原子最多有4个 | |
| C. | 处在同一平面上的原子最多有20个 | |
| D. | 除苯环外的其余碳原子有可能都在同一直线上 |
| A. | H2的生成速率与I2的生成速率相等 | |
| B. | 若单位时间内生成n mol H2的同时生成2n mol HI | |
| C. | H2、I2、HI的浓度相等 | |
| D. | 反应容器内的压强不随时间的变化而变化 |
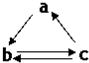 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |
| A. | CH3CH3 | B. | CH3CHCl2 | C. | CH3CH2OH | D. | CH3CH2Br |
| A. | Cu---Cu(OH)2 | B. | H2O2--O2 | C. | CaCO3---CaCl2 | D. | K2CO3--KCl |
| A. | 葡萄糖和果糖互为同分异构体 | |
| B. | 淀粉、油脂、蛋白质均能发生水解反应 | |
| C. | 乙醇可使酸性高锰酸钾溶液褪色 | |
| D. | 苯和溴水在FeBr3的条件下可制得溴苯 |
 A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).