题目内容
(1)(4分)写出下列物质在水溶液中的电离方程式:
HNO3 Ba(OH)2
NaHCO3 NaHSO4
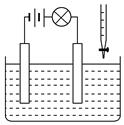
(2)(4分)在实验室制备氯气的过程中,多余的氯气通常是用氢氧化钠溶液进行吸收,请写出此反应的化学方程式并标出电子转移的方向和数目。
该化学反应中,氧化剂是 ,还原剂是 。
HNO3 Ba(OH)2
NaHCO3 NaHSO4
(2)(4分)在实验室制备氯气的过程中,多余的氯气通常是用氢氧化钠溶液进行吸收,请写出此反应的化学方程式并标出电子转移的方向和数目。
该化学反应中,氧化剂是 ,还原剂是 。
(1)(4分) HNO3=H++NO3– Ba(OH)2=Ba2++2OH–
NaHCO3=Na++HCO3– NaHSO4=Na++H++SO42–
(2)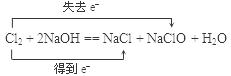 Cl2 Cl2
Cl2 Cl2
NaHCO3=Na++HCO3– NaHSO4=Na++H++SO42–
(2)
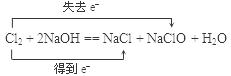 Cl2 Cl2
Cl2 Cl2试题分析:(1)酸能电离出H+和酸根离子,故HNO3电离方程式为:HNO3=H++NO3–;碱电离出金属离子和OH–,故Ba(OH)2电离方程式为:Ba(OH)2=Ba2++2OH–;弱酸的酸式盐电离时产生的是金属离子和酸式酸根离子,故NaHCO3电离方程式为:NaHCO3=Na++HCO3–;强酸的酸式盐能完全电离出H+,故NaHSO4电离方程式为:NaHSO4=Na++H++SO42–。
(2)在氯气跟氢氧化钠溶液的反应中,氯元素的化合价既降低(由0价降到–1价)又升高(由0价升到+1价),所以氯气既是氧化剂又是还原剂。

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
 3C(g)+D(s)的影响
3C(g)+D(s)的影响