题目内容
4.基态Fe原子有4个未成对电子,Fe2+的电子排布式为[Ar]3d6.可用铁氰化钾溶液检验 Fe2+,发生反应的离子方程式为2[Fe(CN)6]3-+3Fe2+═Fe3[[Fe(CN)6]2↓.分析 根据Fe原子的核外电子排布式确定未成对电子数,失去2个电子变为亚铁离子,含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀来解答;
解答 解:26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,基态Fe原子核外处在能量最高的能级为3d,排布了6个电子,有6种不同的运动状态,可知在3d上存在4个未成对电子,失去2个电子变为亚铁离子,亚铁离子的电子排布式为1s22s22p43s23p43d6,Fe2+与铁氰化钾K3[Fe(CN)6]反应生成具有特征蓝色的铁氰化亚铁沉淀:2[Fe(CN)6]3-+3Fe2+═Fe3[[Fe(CN)6]2↓;
故答案为:4,[Ar]3d6,2[Fe(CN)6]3-+3Fe2+═Fe3[[Fe(CN)6]2↓;
点评 本题考查原子核外电子排布规律的运用以及离子的检验,侧重考查学生对知识的迁移应用、需要学生具备扎实的基础,对学生的思维能力有一定的要求,难度中等.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | Na2O2可作为潜艇工作人员的供氧剂 | |
| B. | 电解熔融NaCl可制得Na单质 | |
| C. | Fe3O4通常作为油漆原料 | |
| D. | 可用Ba(OH)2溶液区别NaHCO3溶液和Na2CO3溶液 |
12.将过量Na2O2固体加入到Ca(HCO3)2溶液中,下列有关说法正确的是( )
| A. | 溶液中只有气体产生 | |
| B. | 溶液中只有沉淀产生 | |
| C. | 溶液中有反应:Ca2++OH-+HCO-3═CaCO3↓+H2O发生 | |
| D. | 溶液中有反应:Ca2++2OH-+2HCO-3═CaCO3↓+CO32-+2H2O发生 |
19.在Fe2(SO4)3和 FeSO4的固体混合物(无结晶水)中,如果硫元素质量分数a% 则铁元素质量分数为( )
| A. | 1.31a% | B. | 2.25a% | ||
| C. | (100-3a)% | D. | 条件不够无法确定 |
13.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)═C(石墨)△H=-1.9kJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
14.下列说法正确的是( )
| A. | 标准状况下1molSO3的体积为22.4L | B. | 标准状况下CO2的密度比SO2大 | ||
| C. | 1molSO42-的质量为94g | D. | 1molOH-含有10mol电子 |
 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去). ;
;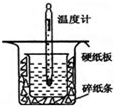 (1)用 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)用 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: