题目内容
下列顺序不正确的是
A.热稳定性:HF > HCl > HBr > HI
B.微粒的半径:Cl-> Na+ > Mg2+ > Al3+
C.电离程度(同温度同浓度溶液中):HCl > CH3COOH > NaHCO3
D.分散质粒子的直径:Fe(OH)3悬浊液 > Fe(OH)3胶体 > FeCl3溶液
C

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
|
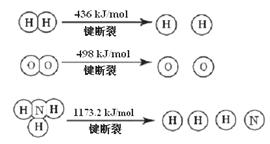
(1) 计算断裂1 mol N≡N键需要能量 kJ , 氮气分子中化学键比氧气分子中的化学键键 (填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) = 2NO (g) ΔH = +180.8 kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是 。
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙两种方式分别投料(物质的量如下表)所示,发生反应:3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
 ①3H2 (g) + N2 (g)
①3H2 (g) + N2 (g)  2NH3 (g)的平衡常数表达式
2NH3 (g)的平衡常数表达式
②判断乙容器中反应进行的方向 。(填“正向”或“逆向”)
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式 。
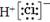
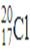 D.O的原子结构示意图:
D.O的原子结构示意图: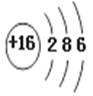
 2NH3 (g) ΔH = -92.4 kJ/mol
2NH3 (g) ΔH = -92.4 kJ/mol