��Ŀ����
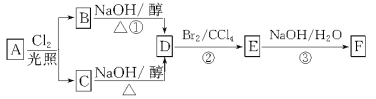
����Ŀ��A��B��C��D��EΪ���ֶ�����Ԫ�أ�ԭ��������������ԭ�Ӱ뾶��D��E��B��C��A��˳����С��A��Dλ��ͬһ���壬C��Eλ��ͬһ���壻A��D��ԭ�Ӻ���������֮��ΪC��E��ԭ�Ӻ���������֮�͵�һ�룻B���⻯����������������Ӧ��ˮ���ﷴӦ����һ���Σ�DԪ������������Ԫ�ؾ����γ����ӻ�����Իش��������⣺
(1)EԪ�ص����ӽṹʾ��ͼΪ_______��Ԫ��A��D�γɵĻ�����ĵ���ʽΪ____________��
(2)�Ƚ�Ԫ��C��E���⻯��е�ߵͣ�HnC__ HnE (�>����<��)������ԭ��(�û�ѧʽ��ʾ)__________________________________��
(3)B���⻯����������������Ӧ��ˮ���ﷴӦ�����εĻ�ѧ����ʽ__________��
(4)��C��D��E�е�����Ԫ����ɵ����ֻ�������ķ�Ӧ�����ڻ��Ϸ�Ӧ������������ԭ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ______________________��
���𰸡� 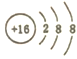 Na+[:H]- > H2O���Ӽ�����������˷е����H2S NH3+HNO3=NH4NO3 Na2O2+SO2=Na2SO4
Na+[:H]- > H2O���Ӽ�����������˷е����H2S NH3+HNO3=NH4NO3 Na2O2+SO2=Na2SO4
��������A��B��C��D��EΪ���ֶ�����Ԫ�أ�ԭ��������������ԭ�Ӱ뾶��D��E��B��C��A��˳����С��
A��Dλ��ͬһ���壬C��Eλ��ͬһ���壻A��D��ԭ�Ӻ���������֮��ΪC��E��ԭ�Ӻ���������֮�͵�һ�룻��AΪHԪ�ء�DΪNaԪ�ء�CΪOԪ�ء�EΪ��Ԫ�أ�B���⻯����������������Ӧ��ˮ���ﷴӦ����һ���Σ���BΪNԪ�أ�
(1)SԪ�صĺ˵����Ϊ16�������ӽṹʾ��ͼΪ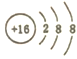 ��Ԫ��H��Na�γɵ����ӻ�����ΪNaH�������ʽΪNa+[:H]- ��
��Ԫ��H��Na�γɵ����ӻ�����ΪNaH�������ʽΪNa+[:H]- ��
(2)H2O���Ӽ�����������е��H2S�ߣ�
(3)N���⻯��NH3��������������Ӧ��ˮ����HNO3��Ӧ�����εĻ�ѧ����ʽΪNH3+HNO3=NH4NO3 ��
(4)��O��Na��S�е�����Ԫ����ɵ����ֻ�������Na2O2��ǿ�����ԣ�SO2�л�ԭ�ԣ����߿ɷ�����Ӧ��Na2O2+SO2=Na2SO4���˼����ڻ��Ϸ�Ӧ������������ԭ��Ӧ��