题目内容
 某学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液,
某学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液,(1)该学生盛装标准液的仪器和指示剂选用正确的一组是
| 序号 | 选用指示剂 | 选用滴定管 |
| A | 石蕊 | (乙) |
| B | 甲基橙 | (甲) |
| C | 酚酞 | (甲) |
| D | 酚酞 | (乙) |
a.用酸式滴定管取盐酸溶液25.00mL,注入锥形瓶中,加入指示剂.
b.用蒸馏水洗干净滴定管.
c.用待测定的溶液润洗酸式滴定管.
d.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下.
e.检查滴定管是否漏水.
f.另取锥形瓶,再重复操作一次.
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
(3)若采用(1)选择进行实验,滴定终点为
(4)已知滴定管中装有浓度为0.1120mol/L的氢氧化钠.逐滴加入到装有盐酸溶液的锥形瓶中.开始时读数及恰好反应时氢氧化钠溶液的读数见表.
实验编号 |
待测盐酸溶液体积(mL) |
滴定开始读数(mL) |
滴定结束读数(mL) |
| ① |
25.00 |
0.00 |
23.80 |
② |
25.00 |
1.00 |
24.78 |
| ③ |
25.00 |
0.22 |
24.04 |
(5)下面操作会导致待测盐酸的浓度偏大的是
a.其它操作均正确,滴定终点读数时,仰视滴定管的刻度
b.盛装待测液的锥形瓶用水洗后未用所装待测液润洗
c.盛装待测液的酸式滴定管未用待测液润洗
d.盛装标准液的碱式滴定管未用标准液洗.
(2)中和滴定有检漏、洗涤、润洗、装液、滴定等操作;
(3)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)先根据数据的有效性,3组数据均有效,然后求出3组数据平均消耗V(盐酸),接着根据盐酸和NaOH反应求出C(NaOH);
(5)根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
(2)中和滴定按照检漏、洗涤、润洗、装液、滴定等顺序操作,故答案为:e;b;c;a;g;
(3)当滴入最后一滴氢氧化钠溶液后,锥形瓶内最后溶液由无色突变为粉红色,且保持半分钟颜色不发生变化,故答案为:当滴入最后一滴氢氧化钠溶液后,锥形瓶内最后溶液由无色突变为粉红色,且保持半分钟颜色不发生变化;
(4)氢氧化钠溶液的体积分别为:23.80mL,23.78mL,23.82mL,氢氧化钠溶液的平均体积为23.80mL,
HCl+NaOH=NaCl+H2O
0.025L×c(HCl ) 0.02380L×0.1120mol/L
则c(HCl )=
| 0.02380L×0.1120mol/L |
| 0.025L |
故答案为:0.1066mol/L;
(5)a.其它操作均正确,滴定终点读数时,仰视滴定管的刻度,造成V(标准)偏大,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
b.盛装待测液的锥形瓶用水洗后未用所装待测液润洗,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
c.盛装待测液的酸式滴定管未用待测液润洗,待测液的物质的量偏小,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
d.盛装标准液的碱式滴定管未用标准液洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
故选:a、d.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
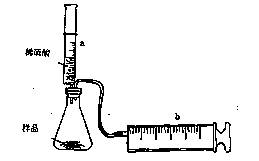 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
|
|
50mL稀硫酸 |
50mL稀硫酸 |
50mL稀硫酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:
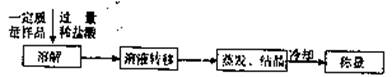
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
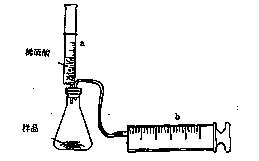 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
| 50mL稀硫酸 | 50mL稀硫酸 | 50mL稀硫酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:
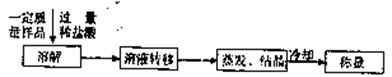
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
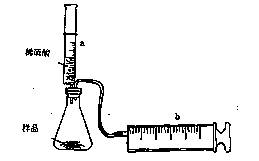 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
|
| 50mL稀硫酸 | 50mL稀硫酸 | 50mL稀硫酸 |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
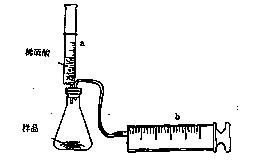 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
| | 50mL稀硫酸 | 50mL稀硫酸 | 50mL稀硫酸 |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:

在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。