��Ŀ����
���к�NH3Ϊ1.7mg?L�D1�ķ�ˮ300m3���ܶ�Ϊ1g?cm�D3�����ɲ����������ַ������д�����
��1������һ���Ѽ״����뺬���ķ�ˮ�У���һ�����������·�����Ӧ��
2O2 + NH3 === NO3�� + H+ + H2O, 6NO3�D + 6H+ + 5CH3OH�� 3N2�� + 5CO3�� + 13H2O.
���ô˷�������������ÿ����ת����Ϊ100%����Ҫ�״����ٿˣ�
(2)���������Է�ˮ���м�������������NH3ȫ������������������NH3��һ����������������������������������Ϊ20%���������������Ϊ80%������������Ҫ��Ӧ�У�
4NH3 + 5O2 ![]() 4NO + 6H2O , 4NO + 3O2 + 2H2O === 4HNO3��
4NO + 6H2O , 4NO + 3O2 + 2H2O === 4HNO3��
����Ӧ�У�4NH3 + 3O2 === 2N2 + 6H2O.�����Ļ��������Ϊ��NO27mol, O218mol, N2225mol��������HNO3��������NO��O2����Ӧ������NH3ת��ΪNO��HNO3��ת���ʸ��Ƕ���
��1���ɷ�Ӧ��2O2 + NH3 === NO3�� + H+ + H2O,
6NO3�� + 6H+ + 5CH3OH �� 3N2�� + 5CO2�� +13H2O
�ù�ϵʽ��6NH3�D�D6NH3���D�D5CH3OH�D�D3N2��
��ˮ�У�n(NH3)=![]()
��ÿ�촦����ˮ��x kg�״�
���ݹ�ϵʽ 6NH3 �D�D 5CH3OH
6mol 5��32��10��3
![]() x
x
x=0.8kg��2�֣�
������״�0.8kg.
(2)NH3ת��ΪNO��ת����Ϊ��![]() (2�֣�
(2�֣�
�����ÿ���Ϊymol�����ɵ�HNO3Ϊxmol,
����Nԭ���غ��У�27+225��2+x=0.8y��2+30 ��
���ݵ�ʧ�����غ��У�![]() ��
��
���Ϸ��̢١��ڣ����![]()
��NH3ת��ΪHNO3��ת����Ϊ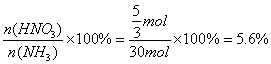 (3��)
(3��)

 ������ϵ�д�
������ϵ�д� �żӾ���ϵ�д�
�żӾ���ϵ�д�




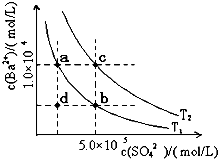


 1.7mol/L����������ʹBaSO4�е�SO42-ȫ��ת������Һ�У���Ҫ�������� �Ρ�[��ʾ�� BaSO4��s��+ CO32- (aq)
1.7mol/L����������ʹBaSO4�е�SO42-ȫ��ת������Һ�У���Ҫ�������� �Ρ�[��ʾ�� BaSO4��s��+ CO32- (aq) BaCO3��s��+ SO42- (aq) ]
BaCO3��s��+ SO42- (aq) ]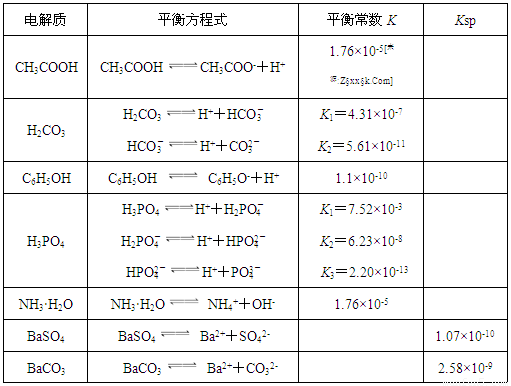
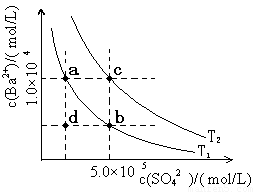
 BaCO3��s��+ SO42- (aq) ]
BaCO3��s��+ SO42- (aq) ]