题目内容
下列说法正确的是( )
A.已知:H2(g)+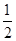 O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1
O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1
B.已知:S(g)+O2(g)===SO2(g) ΔH1=-Q1 ;S(s)+O2(g)===SO2(g) ΔH2=-Q2,则Q1<Q2
C.已知: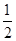 H2SO4(浓)+NaOH(aq)="=="
H2SO4(浓)+NaOH(aq)="==" 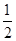 Na2SO4(aq)+H2O(l) ΔH1;
Na2SO4(aq)+H2O(l) ΔH1;
CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2|
D.已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1
CO(g)+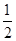 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1641.0 kJ·mol-1
【答案】
D
【解析】
试题分析:A项H2的燃烧热应该为285.8 kJ·mol-1;B项S(g)转化为S(s)需要放热,所以Q1>Q2;C项浓硫酸遇水放热;CH3COOH反应过程电离吸热,则|ΔH1|>|ΔH2|;D项利用盖斯定律可知正确。
考点:考查热化学方程式的正误及盖斯定律的应用。
点评:特别提醒:方程式相加减,则反应热也要相加减,本题属于简单题。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案
相关题目